https://www.cphi.cn 2018-01-25 09:48 来源:CPhI制药在线 作者:zhulikou431
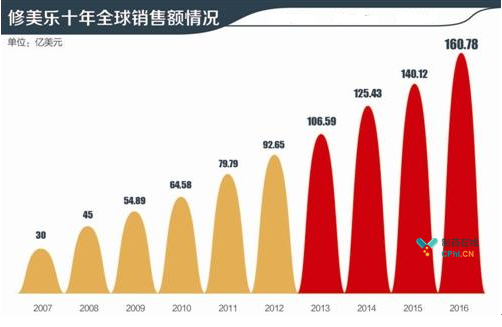
近年来全球生物制药市场呈现高速增长态势,生物药持续火爆,其中最主要的原因是其在重大疾病治疗领域所表现出来的明显临床优势,艾伯维的Humira(修美乐,阿达木单抗注射液)自2012年以来成为连续多年全球销量第一的生物制剂,销售额逐年直线攀升(如下图)。
生物药火爆的同时也激发了生物类似药的崛起和成长,我们首先从生物类似药的基本概念对其作简要了解:
对于生物类似药(biosimilar)的定义,各国并无统一的、标准的定义和看法。目前国际上比较有影响力的机构组织的定义如下:
世卫组织(WHO):"A biotherapeutic product which is similar in terms of quality,safety and efficacy to an already licensed reference biotherapeutic product."(与一种已经批准的参比生物治疗产品在质量、安全性和效力方面均相似的生物治疗产品。)
欧盟EMA:"A biological medicine that is developed to be similar to an existing biological medicine(the'reference medicine').When approved,a biosimilar's variability and any differences between it and its reference medicine will have been shown not to affect safety or effectiveness."(与已经存在的生物药(即:参比药)类似的生物药。在批准时,该生物类似药自身的可变性以及与参比药的任何不同之处均应被证明不影响仿制药的安全性和有效性。)
美国FDA:"A biological product that is highly similar to a U.S.licensed reference biological product not with standing minor differences in clinically inactive components,and for which there are no clinically meaningful differences between the biological product and the reference product in terms of the safety,purity and potency of the product."(与一种美国批准的参比生物产品高度相似,尽管无活性组分有小的差异;在临床上和参比生物产品相比在安全性、纯度与效力方面没有显著差异。)
而在国内,2015年3月,CFDA在其发布的《生物类似药研发与评价技术指导原则(试行)》文件中首次将biosimilar称为"生物类似药"。生物类似药,也被称为生物仿制药,是与已批准的生物原研药相似的一种生物药(包括**、血液及血液成分、体细胞、基因治疗、组织和重组治疗性蛋白等)。
2016-2020全球将迎来单抗生物药的专利到期高峰,一些重磅炸 弹级别的生物制品将陆续专利过期,生物类似药的发展将有势如破竹之势。生物类似药特点是空间大、重磅多、壁垒高,也正是由于生物类似药的研发壁垒高,降价幅度较低(10%~35%),因此可以获得更大的市场和更高的利润。根据预测,2020年全球生物类似药市场规模为350亿美元。
美国就生物类似物出台了相关的法律、法规以及和技术指南文件。2009年颁布的《生物制品价格竞争和创新法》(BPCI Act)和2010年颁布的《患者保护与平价医疗法案》(Patient Protection and Affordable Care Act)规定了生物类似药的简化审批流程(abbreviated licensure pathway)。2012年至今,FDA陆续发布了若干关于生物类似药的指南文件,如《证明与参照药具有生物相似性的质量考虑要点》、《证明与参照药具有生物相似性的科学考虑要点》、《生物类似药:关于2009年版〈生物制品价格竞争与创新法案〉实施办法的问答》以及生物类似药可互换性(Interchangeability)的指导原则草案等。
目前全球获批生物类似药集中在生长激素、促红细胞生成素、粒细胞集落刺激因子、阿达木单抗、 英夫利西单抗、利妥昔单抗等几个专利已过期的大品种,美国的监管较为严格和谨慎,截止到目前为止,FDA批准的生物仿制药有9个,但是还有更多的在开发管线中,具体情况如下:
2015年3月7日,山德士公司的生物类似药Zarxio(filgrastim-sndz)由FDA批准,是安进公司商标名产品Neupogen(filgrastim)的生物类似药,帮助患者恢复在癌症治疗后耗尽白细胞,这是美国批准的第一个生物类似物。
2016年,FDA的CDER批准了三种生物仿制药:韩国Celltrion公司的Inflectra (infliximab-dyyb),杨森Remicade的生物类似药;
山德士的Erelzi(etanercept-szzs),安进重磅产品Enbrel的生物类似药,通过干扰体内称为肿瘤坏死因子的物质来治疗类风湿性关节炎等自身免疫性疾病,Erelzi是FDA批准的首个依那西普生物类似药,也是诺华山德士在美国市场继Zarxio(安进Neupogen[gilgrastim,非格司亭]的生物类似药)之后获批的第二款生物类似药;
安进的Amjevita(adalimumab-atto),艾伯维品牌药Humira的生物类似药。Amjevita成为美国市场首个Humira生物仿制药,将用于全部7种炎症性疾病的治疗,包括:中度至重度类风湿性关节炎(RA)、中度至重度多关节型幼年特发性关节炎(pJIA)、银屑病关节炎(PS)、强直性脊柱炎(AS)、中度至重度慢性斑块型银屑病、成人中度至重度克罗恩病和中度至重度溃疡性结肠炎。
2017年,CDER批准了5个新的生物类似药:Cyltezo (adalimumab-adbm), 艾伯维Humira(阿达木单抗)的生物类似药,批准用于治疗类风湿性关节炎,幼年特发性关节炎,强直性脊柱炎,银屑病关节炎,克罗恩病,溃疡性结肠炎和斑块状银屑病。
Ixifi (infliximab-qbtx), Remicade(英夫利昔单抗)的生物类似药,其可用于治疗类风湿性关节炎,银屑病关节炎,强直性脊柱炎,克罗恩氏病,斑块型银屑病和溃疡性结肠炎。
Mvasi (bevacizumab-awwb), Avastin(贝伐珠单抗)的生物类似药,用于治疗多种类型的癌症,包括治疗某些患者的转移性结直肠癌,非鳞状非小细胞肺癌,成胶质细胞瘤,转移性肾细胞癌和宫颈癌。
Ogivri (trastuzumab-dkst),Herceptin(曲司珠单抗)的生物类似药,用于治疗肿瘤过度表达HER2基因的乳腺癌或转移性胃癌(胃或胃食管交界性腺癌)患者。
Renflexis(infliximab-abda),也是Remicade(英夫利昔单抗)的生物类似药(见上面的Ixifi)。
众多的生物类似药获批,市场竞争势必会更加激烈,但市场竞争的加剧的同时也会使患者和医疗系统的成本大幅降低,目前生物制药行业对开发这些产品表现出极大的兴趣,CDER则希望更多的生物类似申请能被提交。
参考资料:Advancing Health Through Innovation 2017 New Drug Therapy Approvals
笔者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030