https://www.cphi.cn 2018-04-17 10:29 来源:药明康德
CAR-T细胞疗法属于过继性T细胞转移(adoptive T-cell transfer,ACT)的一种,这是输血医学的一个新领域,涉及淋巴细胞回输以实现抗肿瘤,抗病毒或抗炎作用。该领域从临床前研究到临床应用一直得到快速发展,去年我们见证了两款CAR-T细胞疗法的上市,用来治疗白血病和淋巴瘤。作为第一款上市的CAR-T细胞产品Kymriah的主要研发人员,宾夕法尼亚大学的Carl June教授等人在最新的《科学》综述中,描述了目前CAR-T疗法要进入主流肿瘤学领域面临的机遇和挑战。

▲宾夕法尼亚大学Carl H June博士(图片来源:宾夕法尼亚大学)
1、TCR-T和CAR-T
目前,ACT癌症疗法主要有三种类型:肿瘤浸润淋巴细胞(TIL)、T细胞受体(TCR)T细胞和嵌合抗原受体(CAR)T细胞。TCR-T或CAR-T细胞是通过基因转移技术改造外周血T淋巴细胞而生成,CAR-T已经有产品获得FDA批准。TIL治疗的原理在多个临床试验中得以证实,显示出诱导转移性黑素瘤患者的持久完全反应,其能够靶向黑色素瘤中的新抗原。针对这些不同形式的ACT,很多制药和生物技术公司正在进行研发和商业化。
TCR由在T细胞表面与CD3复合物非共价结合的a-和β-链组成。第一种进入临床的TCR-T细胞癌症免疫疗法针对的适应症是转移性黑素瘤,使用TCR结合来自黑素细胞分化抗原的人淋巴细胞抗原A2(HLA-A2)肽。
随后,更高亲和力的TCR被开发出来,针对MART-1表位,通过降低MART-1表达来增强对癌细胞的识别。虽然这样获得了更高的缓解率,但会靶向表达在皮肤,眼睛和耳蜗的正常黑色素细胞。临床中超过一半的患者出现脱靶效应(on-target/off-tumor)**,提示靶向共同抗原会使得有效性和**之间往往只是差之毫厘。另外,靶向肿瘤睾丸抗原MAGE-A3的TCRs产生致死性神经**和心脏**,也对TCR的研发带来新的挑战。
然而,用表达对HLA-A2限制性肽特异性的TCR-T细胞靶向肿瘤睾丸抗原NY-ESO-1,获得临床有效的证据,而且没有显著的**。目前,工程化的NY-ESO-1 T细胞正在进行晚期临床试验 (NCT01343043),或许针对特定肿瘤新抗原的TCR会比靶向肿瘤共有抗原更安全。这一点还需要临床试验进一步证实。
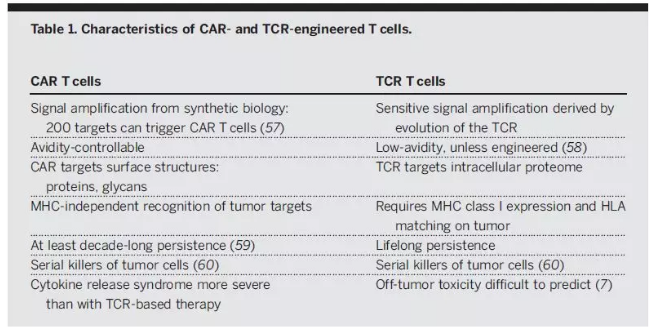
▲TCR-T和CAR-T细胞比较(图片来源:《科学》)
相比之下,CAR结合了抗原结合结构域(最常见的是由抗体可变结构域衍生的单链可变片段(scFv)),TCR?链的信号结构域,以及受体(如CD28,OX40和CD137)的共刺激结构域。CAR克服了工程化TCR的某些局限性,例如需要MHC表达,MHC特性和共刺激信号。由Kuwana和Eshhar领导的小组首次表明了,这些类型的合成受体分子能够使T细胞识别MHC非依赖性靶标。与MHC限制无关的CAR识别,使CAR-T细胞具有显著的抗肿瘤优势,因为肿瘤免疫逃逸的主要机制之一就是肿瘤细胞MHC相关抗原提呈的丢失。目前CAR-T细胞的一个局限性是它们需要靶向肿瘤细胞表面上的抗原。
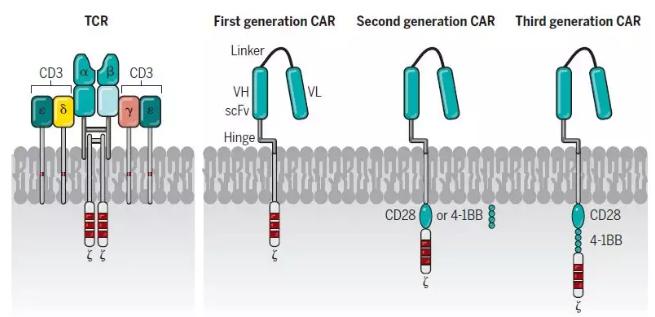
▲TCR-T和CAR-T细胞的构成(图片来源:《科学》)
2、在B细胞血液癌症上大获成功
事实上,使用第一代CAR-T细胞疗法治疗多种癌症的临床试验结果不尽如人意。直到2011年,靶向CD19和编码共刺激区的第二代CAR-T细胞才成为癌症工程化T细胞治疗的主要范式。CD19的几个主要的特征使它成为了近乎理想的治疗靶点:在B细胞癌症中高表达,是人类正常B细胞发育所必需,而且不在B细胞谱系之外表达。
大多数复发性白血病患者在CD19特异性CAR-T细胞治疗后获得完全缓解。但出现了两种形式的抗性。在急性白血病患者中,CD19抗原表位的缺失是肿瘤逃逸的主要机制。在针对青少年和小儿急性白血病患者的临床试验中,CD19表达阴性的患者复发率为28%。在慢性淋巴性白血病(CLL)中,尚无报道发现CD19缺失产生耐药,CLL的耐药性可能是由于细胞输注后CAR-T细胞不能增殖。表2列出了CAR-T细胞疗法在临床治疗中需要克服的几个重要挑战。

▲CAR-T细胞疗法面临的临床挑战和解决策略(图片来源:《科学》)
3、超越B细胞
目前,CAR-T技术已被证明除了靶向CD19之外还有更广泛的应用,针对靶点BCMA和CD22的CAR-T细胞在治疗多发性骨髓瘤和急性淋巴性白血病的早期临床试验中显示出抗肿瘤疗效。然而,BCMA和CD22与CD19一样,高度局限于在B细胞系上表达,因此只对特定组织有效。靶向实体瘤相关的抗原方面仍然没有太多进展。
ERBB2/HER2是肿瘤中过度表达的一种酪氨酸激酶受体,是许多抗体和ADC药物的有效靶标。但是,靶向ERBB2/HER2的CAR-T细胞治疗第一例患者时产生了致命的**。跟多研究发现**是由于低密度表达ERBB2的肺上皮细胞也被CAR-T细胞识别和攻击,引发肺功能衰竭和大量细胞因子释放。因此,研究者采用更低剂量、更低亲和力的CAR- T细胞治疗肉瘤患者,结果显示是安全的,但临床效果有限。
另外,以碳酸酐酶IX(CAIX)抗原作为靶点的一代CAR-T细胞疗法在治疗肾细胞癌的1期临床试验中也意外产生肝**,原因是CAIX抗原在正常胆道上皮细胞也有低密度表达,但这在临床前研究中没有发现。以CEACAM5作为靶点的CAR-T细胞疗法在临床试验中,出现延迟的呼吸**,且与T细胞峰值扩展一致,表明癌症相关抗原潜在的on-target/off-tumor**。
靶向与实体瘤相关的其他共有抗原,如间皮素、癌胚抗原和GD2神经节苷脂的CAR-T疗法在临床试验中未发现明显的**;然而,这些试验中观察到的抗肿瘤活性也很弱。而具有增强的抗肿瘤活性的GD2特异性CAR-T细胞已经在临床前模型中发现会诱导致命的神经**。
另外,肿瘤微环境是ACT疗法成功应用的一大障碍,特别是在实体瘤中。包括免疫检查点(如PD-L1表达)、肿瘤代谢环境的改变(如缺氧或吲哚胺-1-氧化酶和精氨酸酶)、调节性T细胞以及抑制性骨髓细胞。在细胞治疗的过程中,这些免疫和代谢检查点在肿瘤中的表达都会升高,表现出适应性耐药。
目前,PD-1/PD-L1单抗与CD19 CAR-T细胞疗法组合的临床试验正在进行中(例如NCT02926833,NCT02650999和NCT02706405)。除了与检查点抑制剂的组合以外,研究人员还在研发阻断这些抑制通路的替代疗法,例如开关受体或基因编辑。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030