https://www.cphi.cn 2018-04-19 12:01 来源:CPhI制药在线 作者:zhulikou431
随着全球医药制造业迅猛发展,供应链全球化日益加剧,越来越多的资源或关注都集中于确保物料的安全、完整和数据真实。同时,世界各国的药政机构也越来越重视原料药(API)的质量和安全,监管机构持续加大检查力度,因此对于药政当局来说,不同国家和地区之间检查结果的分享具有积极的意义。
2018年4月12日,欧盟EMA发布了《2011-2016年国际API检查方案报告》,该报告对2011年至2016年期间的国际API检查方案的运作提供了一个概览描述。报告根据方案的范围讨论了预期的可交付成果和关键业绩指标,并且根据结果对方案的目标和运作提出了进一步修订的建议。
国际API检查方案(International Active Pharmaceutical Ingredient Inspection Programme)背景
2007年11月,在布鲁塞尔举行的跨大西洋行政简化讲习班上,最终达成了在2008年至2010年期间,在一组国际伙伴之间进行一项旨在GMP检查领域加强国际合作的试验方案。参与试点项目的区域包括澳大利亚、欧洲当局和组织(AFSSAPS/现在的ANSM、AIFA、EDQM、EMA、IMB/现在的HPRA、MHRA和ZLG)和美国;其范围包括在参与区域以外的国家的API制造商的检查。2008年以来,该国际API检查项目一直在运作。2008年末至2010年底是作为试点项目,自2011年1月开始全面实施。
在这过去的6年期间(2011年至2016年),工作组的活动主要集中在分享检查计划以及成果,一些特别关注的地点还包括检查报告的交换。该检查方案的工具包括工作分享工具和交流平台、主清单和检查计划模块、不符合情况的警告以及监管行动。
下面我们一起重点来看一下这几年的成果及关键绩效指标:
□增加了参与当局的检查透明度。
□参与当局检查的API生产场地的数目总体有所增加。
报告中给出一组数据:9个报告机构(EMA, AIFA, ANSM, DKMA,MHRA, EDQM, FDA, TGA, WHO)共提交了944个生产场地的检查数据,其中有458个(所有提交的生产场地的49%)独立场地涉及一般性关注。这458个生产场地位于18个国家:主要是印度(226个,占比49%)中国(165个,占比36%),其余67个位于全球16个国家。如下图1:
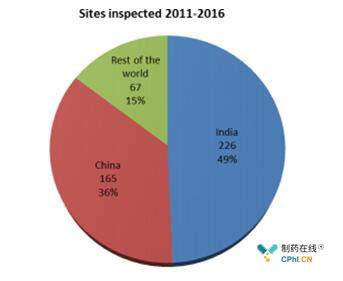
图1 2011-2016期间检查的场所分布
另外这458个场所中,共接受1333次单独检查。在6年期间,参与当局平均每个场所检查2.9次。如下图2

图2 所有参与当局总检查次数(2011-2016)
□重复检查减少
重复检查被定义为两个或更多的药政当局在一定的时间段内(间隔为不到1个月、3个月、6个月、12个月、24个月)检查同一地点,一般间隔时间大于24个月就不会视为重复检查。
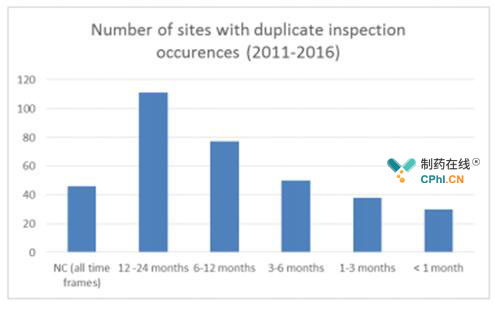
图3 重复检查的数目(2011-2016)
□多个主管当局执行检查的次数增多
在六年期间,43个场址共进行了47次联合检查。四个场所在这段时间内两次举行联合检查。
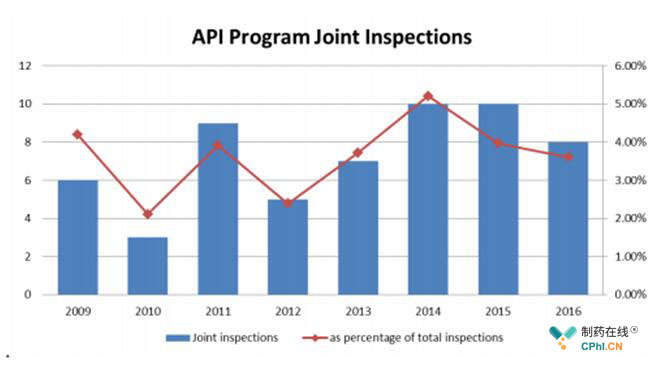
图4 联合检查情况
□参与当局对检查情况的评估
如今,欧洲药品管理局(EMA)及其欧洲和国际合作伙伴已成功地加强了它们之间的相互作用,以提高对全球原料药(API)制造商的监督,正如现在公布的《2011-2016年国际API检查方案报告》中所强调的那样。
这个国际合作允许欧洲药品管理局(EMA)、几个欧盟国家当局(法国、丹麦、爱尔兰、意大利和英国)、欧洲药品质量管理局(EDQM)、美国FDA、澳大利亚治疗性商品管理局(TGA)、加拿大卫生部、日本卫生劳动福利产(MHLW)和药品和医疗器械管理局(PMDA)以及世界卫生组织(WTO)共享境外API制造商的GMP检查信息。
如今,许多制药公司将API的生产外包给遍布世界各地的制造商。这导致对API生产场地检查的需求增加,以确保对这些设施进行充分的监督。这一倡议的总体目标是确保更多的生产场地被监测,通过加强合作,在参与的监管机构之间相互依赖,减少检查的重复和增加检查的覆盖面,从而更好地利用世界各地的检查资源。
信息共享的不断提高,让全面深入检查覆盖面不断扩大,这样会更利于全球公共卫生的发展,因此参与当局都认为这一举措是有益的,并同意继续开展合作。
对于欧美药品用户和监管当局而言,这一国际合作项目代理的利益是显而易见的。但是同时,这个国际合作项目的持续推动,也会对原料药(API)提供商不断造成运营合规压力。例如浙江海正就曾经被联合检查。同时,WHO也会将其他检查机构的结果作为评估是否加大自己检查频率的依据,例如针对秦皇岛紫竹药业的检查。因此说,国内制药企业,尤其是原料药企业,需要对相关当局检查结果带来的连带效应给予持续关注。
参考文件:
1-Increasing oversight of API manufacturing through international collaboration
2-Report on the international Active Pharmaceutical Ingredient (API) inspection programme 2011-2016
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030