https://www.cphi.cn 2018-04-26 10:44 来源:奇点网 作者:代丝雨
本月,NIA-AA提出了新的阿尔茨海默病研究框架,它与数十年来一直使用的方法不同。后者依赖于认知变化,如记忆丧失、空间感错乱、认知障碍等,新的框架则是基于对生物标志物的检测,以实现在症状出现之前判断疾病[1]。
目前,这种框架还仅用于研究,暂时不会进入临床。但是想象一下,在这种框架之下,阿尔茨海默病或许可以像心血管疾病、糖尿病这些慢性疾病一样,在症状出现之前就被早期发现,得到一定程度的控制。
毕竟对于阿尔茨海默病来说,等到症状出现就太晚了。
2018年,第一个终止于三期临床的阿尔茨海默新药出现在4月。vTv Therapeutics宣布终止其RAGE抑制剂药物azlueragon(TTP488)的临床研究,在试验中,服用药物18个月并不能改善患者的认知评分[2]。
许多AD新药都是这样死去的。临床前实验进行得很顺利,在小鼠模型上药物效果都很好,但是一应用到患者身上,却毫无效果。99.9%的失败诅咒笼罩在研究者们的心头,究竟是哪里不对,是动物模型不能完全模拟人类,还是理论从根本上就错了?
纵然80%基因都一样,但小鼠毕竟是小鼠
近期,来自格莱斯顿研究所的华人学者Yadong Huang团队发表了一项最新研究成果,研究者利用来自阿尔茨海默病患者的诱导多能干细胞(iPSC)构筑了人源AD神经元模型,全面揭示了APOE4突变导致AD的机制!更令人激动的是,研究者此前开发的一款小分子结构矫正剂能够对APOE4蛋白的错误结构进行矫正,有望成为AD的新疗法[3]。
研究过程中,研究者还发现,iPSC神经元模型与小鼠模型的病理过程有显著不同,说明AD在不同物种之间的表现差异很大,这很有可能是新药接连失败的原因之一。
APOE4突变是AD的遗传因素之一,许多研究表明APOE4蛋白与β-淀粉样蛋白沉淀(Aβ)和神经纤维缠结(NFTs)都有关系[4],APOE4携带者患AD的风险要更高,第一次发病年龄则更低。举个例子,携带APOE3双等位基因的人,在85岁时患AD的风险约为10%,但是携带APOE4双等位基因的人风险则高达65%[5]!
Huang教授便致力于研究AD与APOE4的关系。他提出了一种有关于APOE4蛋白水解的病理假说:
一般情况下,APOE蛋白是由大脑中的星形胶质细胞表达的,但是在压力或受损的情况下,神经元也会激活APOE表达,来促进神经元的修复。而APOE4蛋白比APOE3蛋白更不稳定,更容易被水解成具有神经**的蛋白碎片。APOE4片段进入胞质,引起tau蛋白病变和线粒体损伤,进一步导致神经元变性。主管学习、记忆等认知功能的海马中的GABA神经元,则是对APOE4蛋白片段的**特别敏感,所以AD患者首先表现为认知障碍。
实际上APOE4与正常的APOE3,在结构上只相差一个氨基酸。APOE3蛋白的112位上是一个半胱氨酸,但是APOE4蛋白的112位上却是一个精氨酸。这直接导致在蛋白进行三维折叠的时候,产生了不同的离子键,关键的结构域变得不一样了。俗话说结构决定功能,所以,有研究者认为,利用一个小化学分子,“干扰”一下蛋白的结构,是有希望让APOE4不管是结构、还是功能都回到正常的APOE3的[4]。
考虑到AD病程很长,动物模型难以囊括全程的病理变化,Huang教授选取了来自APOE4双等位基因携带者和健康人的细胞,利用iPSC技术制作了AD神经元模型,并对一系列病理特征进行了检测。
在APOE4神经元中,完整的APOE蛋白水平要比正常神经元更低,胞内水平少了约35%,分泌出胞外的则少了大约60%。计算过二者的比例之后,研究者发现,APOE4蛋白似乎更倾向于留存在胞内,而不是分泌到胞外。
同时,研究者发现,APOE4神经元内产生的APOE蛋白片段也更多了!这些蛋白的大小在12-20kD之间,与在小鼠模型脑内和人类患者神经元中发现的蛋白片段大小差不多[6,7]!这些蛋白片段仅存于胞内,培养基内没有检测到。
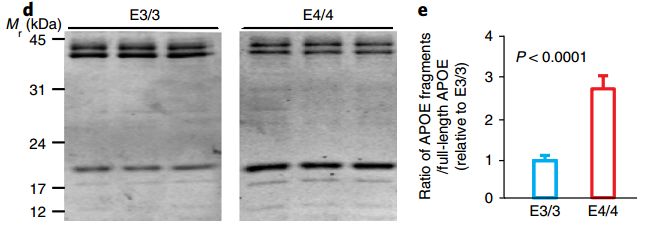
APOE4蛋白碎片要更多
另一方面,与AD有关的两大病理特征,β淀粉样蛋白沉淀(Aβ)与磷酸化tau蛋白(p-tau)在APOE4神经元中都有显著增加,而且p-tau的增加并非受Aβ影响。当研究者利用药物阻断Aβ产生,p-tau水平依旧很高,并没有随之变化。
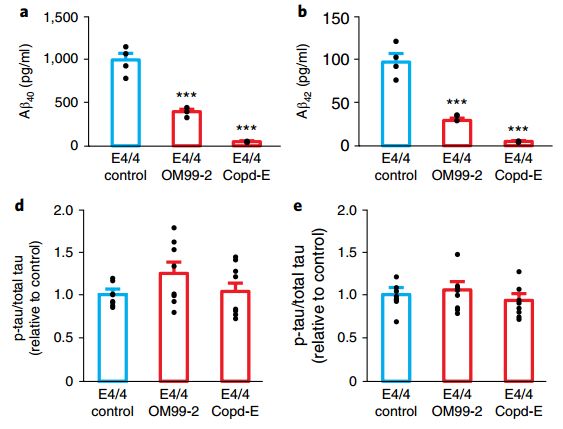
p-tau与Aβ在APOE4中水平较高
利用OM99-2和Copd-E两种分泌酶阻断剂降低Aβ水平,p-tau不受影响
分歧就出现在这里了!研究者经过实验验证,认为APOE4能够促进人类神经元中Aβ的聚集和形成,但是这种现象是不存在于小鼠神经元中的!在小鼠的iPSC神经元中,APOE4突变并不增加Aβ42与Aβ40的水平。这说明,物种之间APOE对Aβ代谢水平的影响是不同的,APOE4能够增加人类神经元中Aβ的产生,但在小鼠神经元中就没有这样的效果。
对功能神经元的实验也证实了Huang教授的假说。在APOE4神经元中,随着神经元的逐渐分化、成熟,GABA能神经元会逐渐丧失功能或者退化,而且60%的GABA神经元中都有p-tau。

APOE4变体GABA神经元水平更低,p-tau水平更高
随后研究者又利用基因编辑方法验证了APOE4对神经元影响的特异性。将APOE4修复为APOE3,使得神经元的诸多AD样病理都恢复了正常,而彻底敲除了APOE基因的“空白”神经元,生理表现则与正常的APOE3神经元基本一致;通过转染APOE4基因,则又会令“空白”神经元产生病理状态。
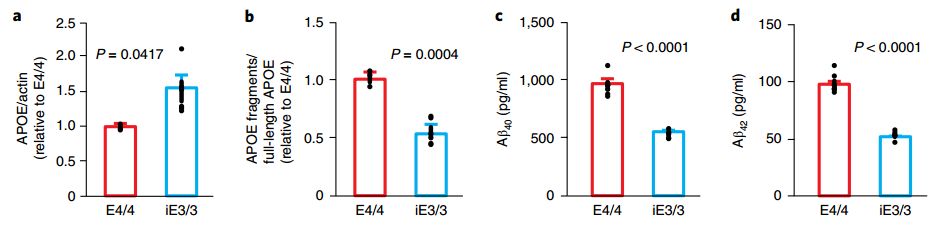
基因编辑使APOE4神经元病理指标下降
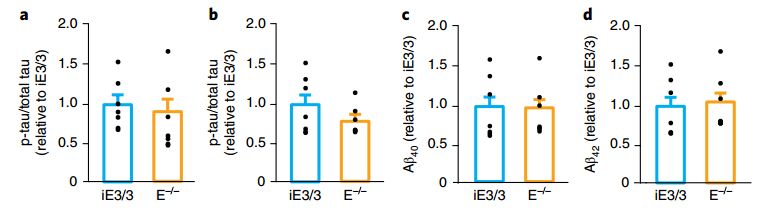
水平与正常APOE3神经元基本一致
这里有一点十分有趣,导致病理状态的APOE4非得是内源产生的不可。研究者给“空白”神经元输入了人工合成的APOE4,结果并没有引起神经元的相关变化。前文我们也说过了,正常情况下APOE蛋白是由星形胶质细胞产生的,但是在压力、损伤等情况下,神经元也会产生APOE蛋白[4]。研究者对不同来源的APOE4蛋白进行了研究,发现APOE4**是神经元特异的,星形胶质细胞产生的APOE4并不会对神经元产生有害影响。
最后,Huang教授利用此前发现的结构矫正子PH002[8]尝试“修复”APOE4神经元。实验结果也达到了研究者的预期,神经元中APOE4蛋白片段水平下降、GABA能神经元数量上升,p-tau、Aβ42、Aβ40产生与分泌的水平都降低了!这说明,这种小分子的结构矫正剂或许可以作为一种治疗AD的新手段!
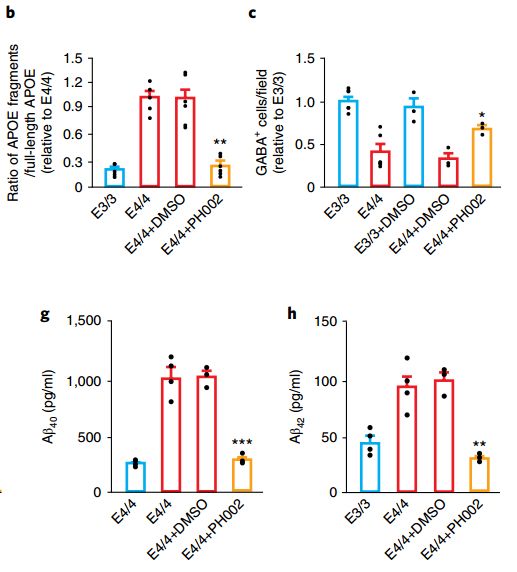
小分子结构矫正剂能够“纠正”APOE4带来的神经元**
对AD的研究进程必须要抓紧了。在上个月召开的阿尔茨海默和帕金森病治疗会议(AAT-AD/PD)上,梅奥诊所的研究者报告说,与近几年的研究不同,痴呆症的发病率不降反升,特别是帕金森、ALS和早发性AD,这种趋势也很有可能延伸至迟发性AD。其他研究者的报告数据也支持了这一观点。[9]
在对AD的预防与治疗上,我们几乎一筹莫展。Huang教授正在与制药企业合作,对这些小分子结构矫正剂进行进一步优化,以便尽快进入临床试验。
期待这一天的到来。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030