9月3日,联邦制药发布公告,宣布1类创新药UBT251注射液用于超重或肥胖症适应症的临床试验注册申请(受理号:CXHL2300699)获得国家药监局临床试验默示许可。这是继日前2型糖尿病适应症(受理号:CXHL2300655)获批临床后,UBT251又一项获批临床的适应症。

国内首家
联邦制药三种激动剂研发加速
据公告显示,联邦制药是国内首家、全球第二家以化学合成多肽法制备的长效GLP-1(胰高血糖素样肽-1)/GIP(葡萄糖依赖性促胰岛素多肽)/GCG(胰高血糖素)三激动剂获批临床的企业。据了解,用于制备多肽药物的方法可分为化学合成法和生物发酵法。其中化学合成法基于方法可靠、成本可控、氨基酸长度可控等优势,占据了当前多肽合成主流地位。
UBT251是联邦制药采用化学合成法制备的一款长效GLP-1/GIP/GCG三靶点受体激动剂,预期临床每周皮下注射给药1次。除上述的2型糖尿病、肥胖症已获批临床外,UBT251还拟被用于非酒精性脂肪肝/非酒精性脂肪肝炎的治疗,此项临床注册申请已处于最后审评阶段。
此外,礼来公司的Retatrutide(LY3437943)同样是一款GLP-1R/GIPR/GCGR三重受体激动剂,人体内平均半衰期长达6天,小鼠体内半衰期为21h(0.47mg/kg)。8月10日,Retatrutide的2期临床研究最新数据被发表于《新英格兰医学杂志》,显示患者耐受性良好,在48周的治疗后与非酒精性脂肪肝相关的心脏代谢标志物(血压、糖化血红蛋白水平、空腹血糖、胰岛素等)得到改善,并且治疗期间展现出显著且具有临床意义的体重减轻。
研发加码下
联邦制药迈进一大步
近年来,随着我国对医药创新支持力度加大,本土药企逐渐研创实力不断提升,展现强大潜力与实力。联邦制药作为国内的综合性企业之一,在创新药研发领域同样有所布局。
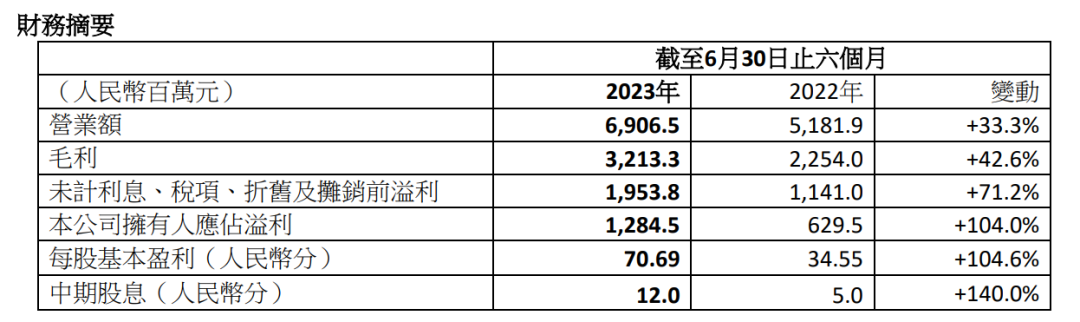
8月30日,联邦制药公布2023年中期业绩,显示在中间体产品及原料药、制剂产品等板块稳健增长下,共录得营业额69.07亿元(+33.3%),毛利同比增加42.6%至32.13亿元。同时,联邦制药多个研发项目取得重要进展。
据公告显示,联邦制药聚焦内分泌、自身免疫、眼科等领域,当前处于开发中的人用药新产品达34项,其中16项为1类新药项目:

今年上半年,联邦制药多款产品取得重大进展:
3月,1类新药TUL12101 滴眼液获批临床;
4月,德谷胰岛素利拉鲁肽注射液药物获批临床;司美格鲁肽注射液用于体重管理的适应症获批临床;
期内,阿莫西林胶囊(规格:0.5g)仿制药通过一致性评价,成为联邦制药第三个通过一致性评价的阿莫西林胶囊品种。
从在研管线来看,联邦制药产品丰富,重点布局的糖尿病领域已有多个项目取得重大进展。此外,联邦制药表示期内共投入3.5亿元用于药品研发,同比增长44.4%。
小结
联邦制药表示,未来将持续致力于新产品研发,并重点提升在生物医药行业的竞争力及创造力,丰富产品管线。随着创新加速、研发加码,不久后联邦制药或将有多款产品取得成绩。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57