据美通社12月21日报道,武田中国旗下抗病毒感染领域创新药物马立巴韦片(®)正式获得NMPA批准,适用于治疗造血干细胞移植或实体器官移植后巨细胞病毒(CMV)感染和/或疾病,且对一种或多种既往治疗(更昔洛韦、缬更昔洛韦、西多福韦或膦甲酸钠)难治(伴或不伴基因型耐药)的成人患者。
据了解,马立巴韦(maribavir)是全球首 个且目前唯一一个靶向并抑制UL97蛋白激酶及其天然底物的抗病毒制剂,其获批将为中国难治性CMV感染或疾病的移植受者提供一种全新的口服治疗选择。
巨细胞病毒(CMV)是一种能感染人类的β疱疹病毒,是移植患者常发生的感染之一,巨细胞病毒(CMV)在实体器官移植患者中的发生率约为16-56%,在造血干细胞移植患者中的发生率约为30-70%。免疫功能正常人群感染巨细胞病毒(CMV)后,通常表现为短时间的发热或无症状。此后,巨细胞病毒(CMV)会在多种细胞中呈终身潜伏状态,成为再次活化的储存,携带者成为易感人群。该病毒不仅使接受移植手术的患者患病风险增加,还可能增加移植排斥、机会性合并感染的风险。
马立巴韦是一款UL97蛋白激酶抑制剂,通过抑制巨细胞病毒(CMV)病毒的pUL97蛋白激酶,阻断病毒的复制,是首 个针对该患者群体的口服疗法,与已有疗法相比具有更高的安全性。
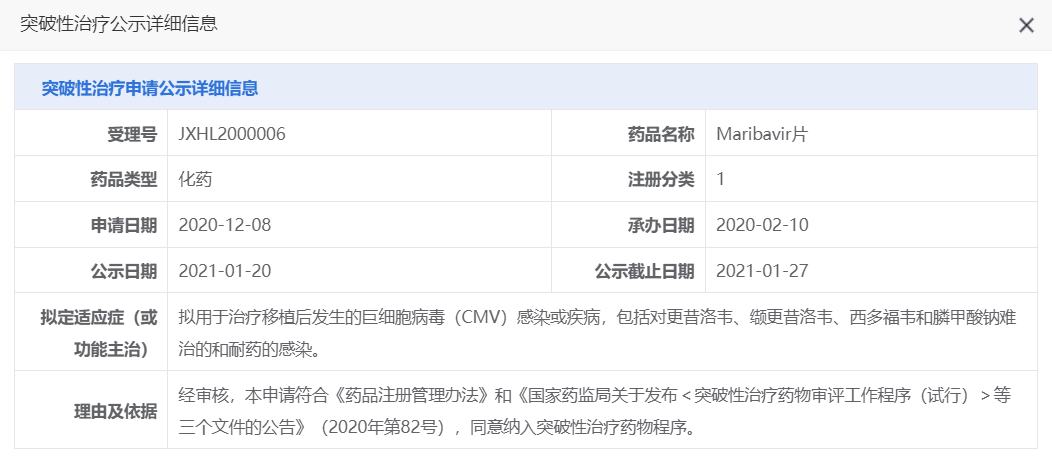
马立巴韦曾被美国FDA突破性疗法认定和优先审评资格,2021年11月,马立巴韦首次获美国FDA批准上市;2022年11月,该药也获得欧盟委员会(EC)批准上市。2021年1月,马立巴韦片被CDE正式认定为"突破性治疗药物品种"。
根据报道,在一项多中心、随机、开放标签、阳性药物对照的Ⅲ期优效性研究(TAK-620-303)中,结果显示有55.7% (n=131/235) 接受马立巴韦片治疗的患者在第8 周达到了CMV血症的清除(即根据中心实验室结果,间隔至少5天的2个连续基线后样本的血浆CMV DNA浓度低于定量下限),而接受常规治疗的患者为 23.9%(n=28/117)(校正后的差异 [95% 置信区间(CI)]:32.8% [22.80–42.74];P <0.001)。
同时,马立巴韦片与常规抗病毒治疗相比,治疗相关毒性更低。研究结果显示,有25%(n=14/56)接受缬更昔洛韦/更昔洛韦治疗的患者发生治疗相关的中性粒细胞减少,而接受马立巴韦治疗的患者仅为1.7% (n=4/234)。同时,有19.1%(n=9/47)接受膦甲酸钠治疗的患者发生了急性肾损伤,而接受马立巴韦治疗的患者仅为1.7% (n=4/234)。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57