国内仿制药研发批准动态
01
新注册分类品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.04.13-04.19)新增1个新注册分类首家过评受理号,涉及1个片剂。与上次统计周期相比,本次增加1个新注册分类首家过评品种。
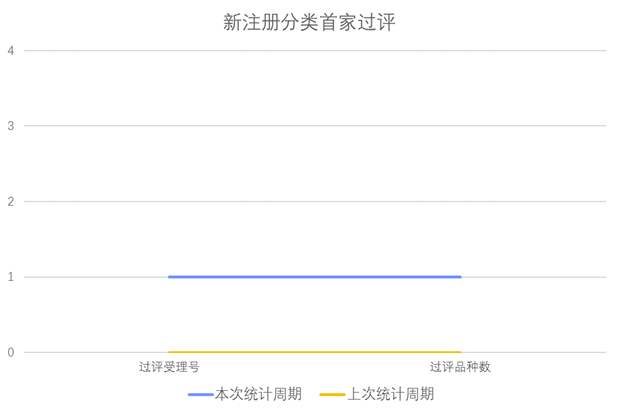
新注册分类品种首家过评情况

02
一致性评价品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.04.13-04.19)新增2个一致性评价首家过评受理号,涉及2个品种,包含1个片剂,1个注射剂。与上次统计周期相比,本次增加2个一致性评价首家过评品种。
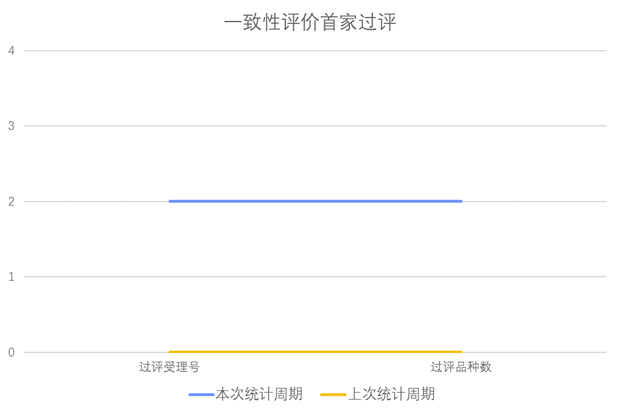
一致性评价品种首家过评情况
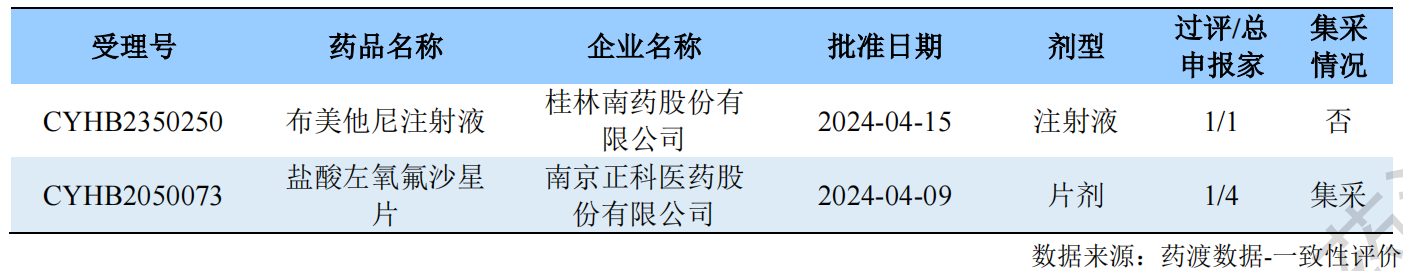
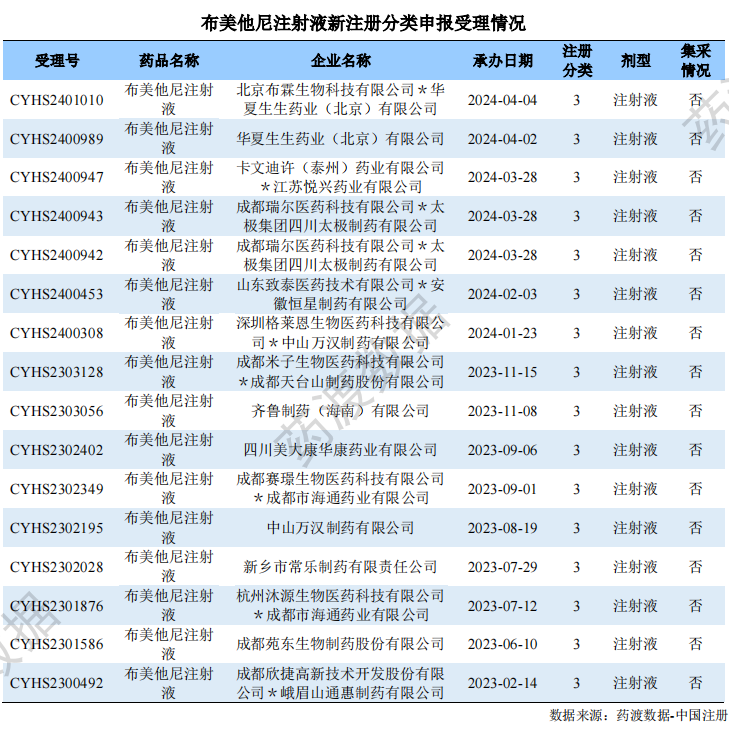
布美他尼注射液
布美他尼是间氨基苯磺酰胺的衍生物,属于一种新型髓袢利尿剂,其作用部位、作用机制和作用特点与呋塞米等相似,利尿强度却是呋塞米的20~60倍,具有高效、速效、短效和低毒的特点,布美他尼的治疗领域十分广泛,已获批多个适应症,包括心力衰竭、肝硬化、肾衰竭、高血压、高钾血症及高钙血症等。根据药渡数据-全球新药库调研,布美他尼在美国正在进行适用于帕金森病的临床研究。
布美他尼最早于1976年4月8日在日本获批上市,由第一三共负责销售;1983年Validus Pharms申报的仿制药品于1983年2月28日获FDA批准上市,商品名为BUMEX。
布美他尼是世界上公认的最安全有效的袢利尿剂之一,已在欧美国家作为安全利尿剂的临床首选用药,并进入我国医保乙类品种。
根据药渡数据-仿制药库调研,目前全球获批的布美他尼共包括3种剂型:片剂、冻干粉针剂和注射液。其中布美他尼注射液是目前国内外市场的主流品种。截至目前,尚未有布美他尼注射液原研药品在国内获批上市,目前国内共有20家企业拥有布美他尼注射液的生产批文。
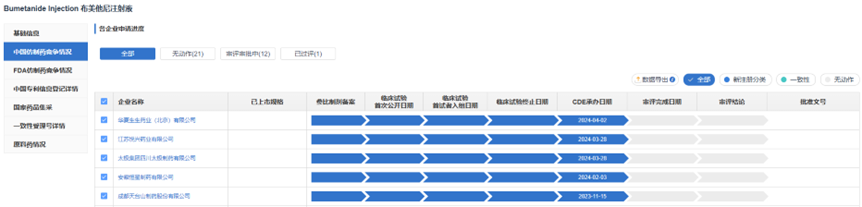
篇幅原因,仅展示前五家企业申报进展情况,更多信息,请查看药渡数据-仿制药库
根据药渡数据-中国注册库信息显示,国内药企从去年开始“扎堆”进行布美他尼注射液的仿制报产,目前该品种的申报格局是1+21。
桂林南药于4月15日通过一致性评价审评,成功拿下布美他尼注射液的“首家”过评称号。另外21家企业的新3类报产申请已获受理或在审中。
药渡数据-中国销量库统计数据显示,布美他尼注射液近几年销售情况持续走高,2022年度销售额超过2.24亿元,2023Q1~3销售额已超过2.49亿元,全年销售再次创造新高峰已是“板上钉钉”。
《中国心血管健康与疾病报告2020》统计数据显示,我国心衰患者达到890万人。心衰患者病死率随患病时间增加而快速升高,据相关研究表明,心衰患者1年内死亡率约20%,5年死亡率将达到50%。心衰药物治疗中利尿剂的使用是关键,若能及时对心衰患者采取最 佳治疗,就能显著降低死亡风险,降低幅度可能多达50%。此外,随着老龄化人口的攀升,我国高血压、心衰、肾衰和肝硬化患者数量将不断增加。因此利尿剂应用需求持续攀升,用药规模持续增长,市场潜力巨大。桂林南药占据布美他尼注射液9成以上市场份额,此次拿下“首家过评”,将进一步巩固桂林南药的“江湖老大”的市场地位,提升公司的影响力。
03
新注册分类品种批准上市情况
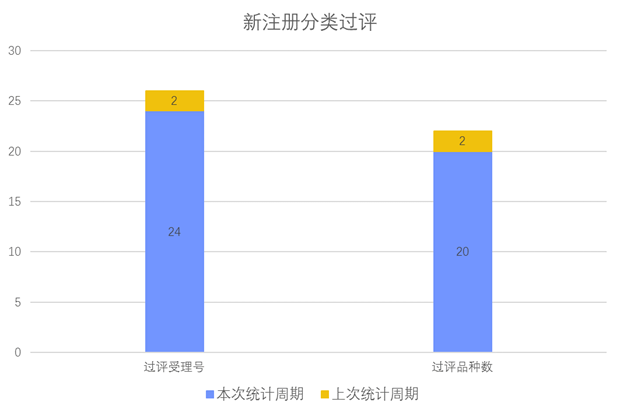
根据药渡数据调研,本次统计周期(2024.04.13-04.19)新注册分类新增24个过评受理号,涉及20个品种,包含1个滴眼剂,2个胶囊剂,7个片剂,1个散剂,2个吸入溶液剂,7个注射剂。与上次统计周期相比,本次新增18个新注册分类过评品种。
新注册分类品种过评情况(部分)
04
一致性评价品种批准上市情况
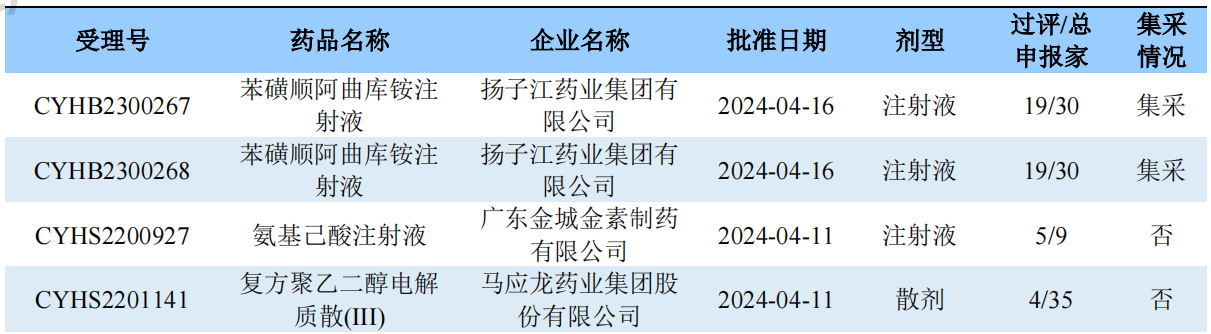
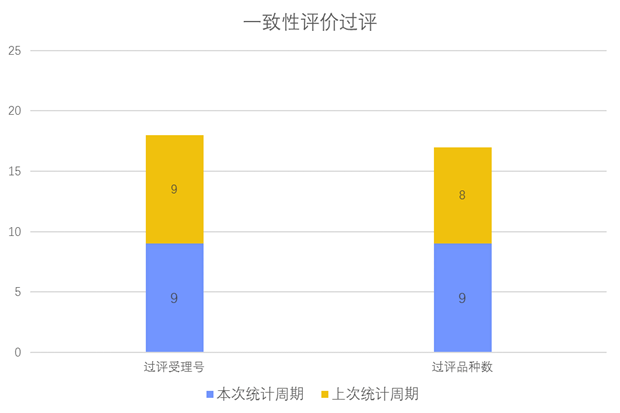
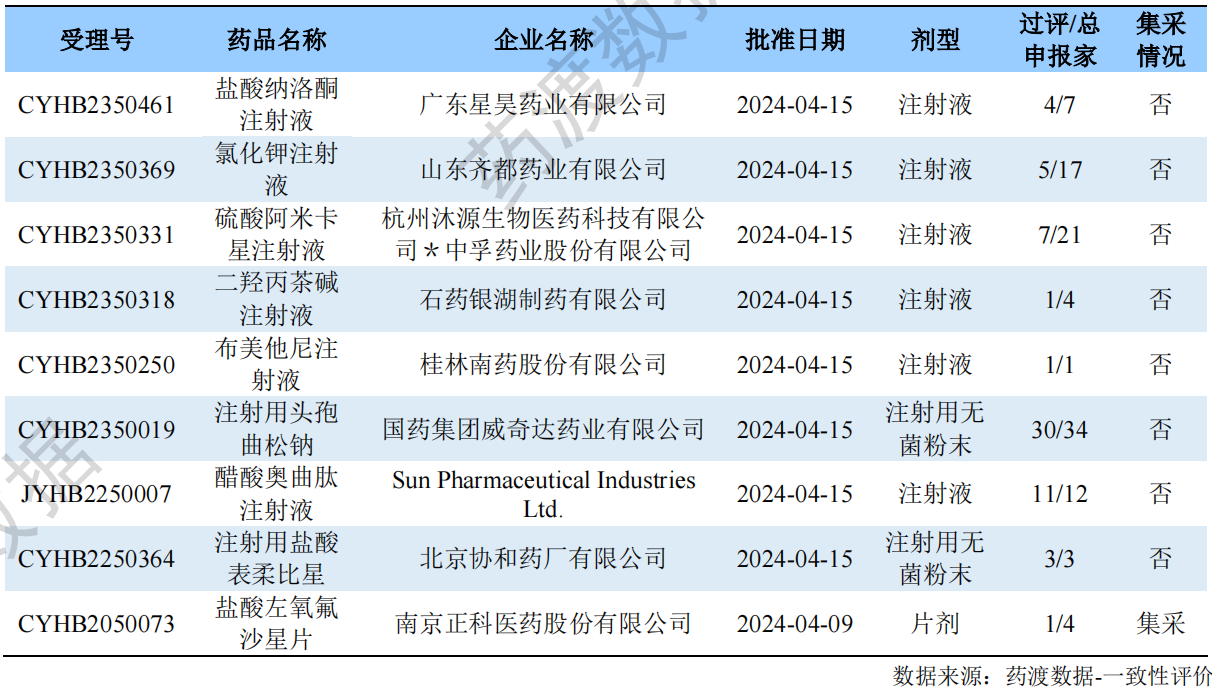
根据药渡数据调研,本次统计周期(2024.04.13-04.19)一致性评价新增9个过评受理号,涉及9个品种,包括1个片剂,8个注射剂。与上次统计周期相比,本次新增1个一致性评价过评品种。
一致性评价品种过评情况
05
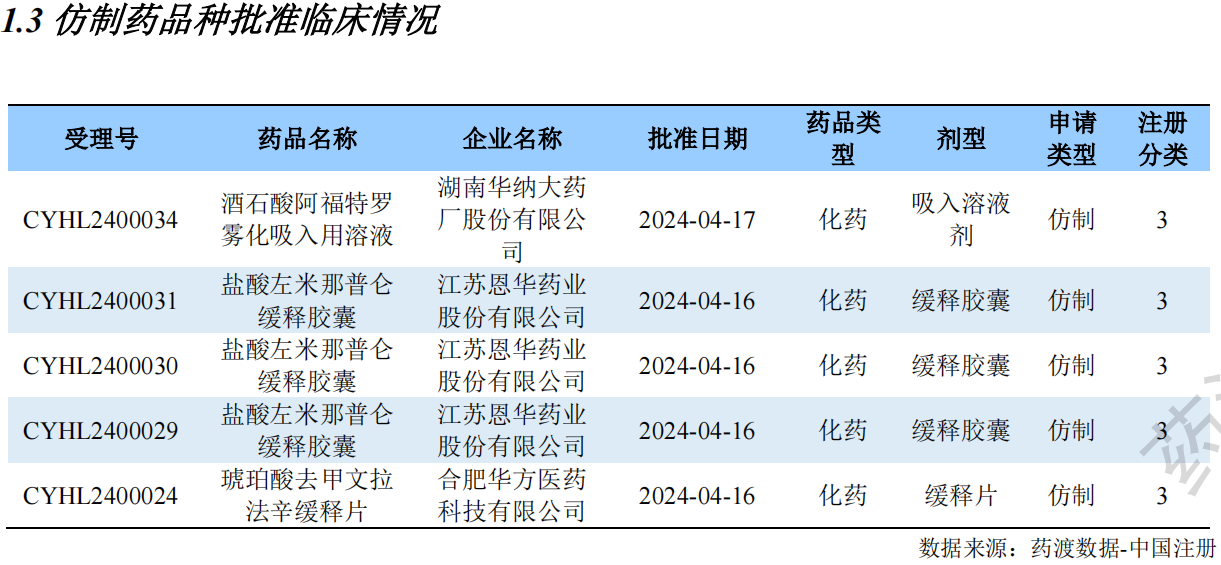
仿制药品种批准临床情况
国内仿制药研发申报动态
01
新注册分类品种申报上市情况
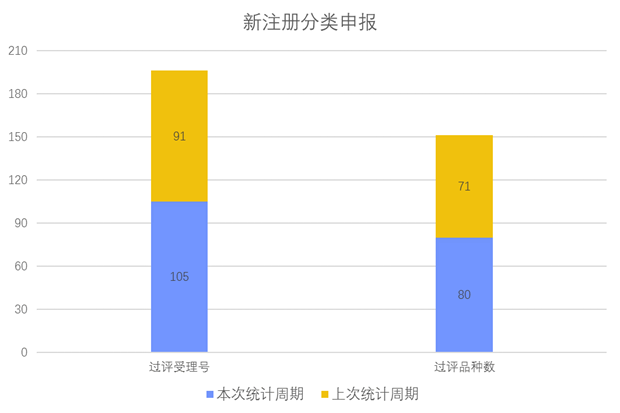
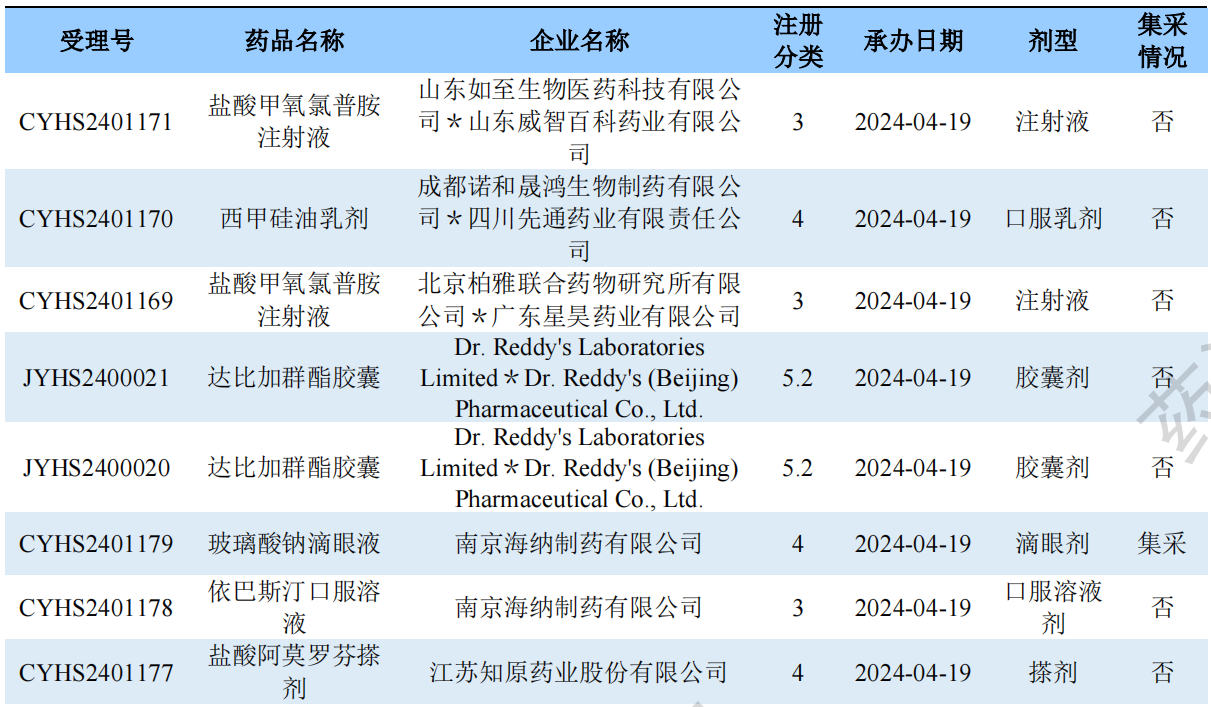
根据药渡数据调研,本次统计周期(2024.04.13-04.19)新注册分类数据新增105个新报受理号,涉及80个品种,包括1个搽剂,2个滴眼剂,1个干混悬剂,1个混悬液,4个胶囊剂,1个颗粒剂,9个口服溶液剂,2个口服乳剂,2个凝胶剂, 2个凝胶贴膏,20个片剂,1个乳膏剂,1个软膏剂,1个散剂,1个糖浆剂,1个吸入粉雾剂,3个吸入溶液剂,27个注射剂。与上次统计周期相比,本次增加9个新注册分类申报品种。
新注册分类品种申报受理情况(部分)
02
一致性评价品种申报上市情况
根据药渡数据调研,本次统计周期(2024.04.13-04.19)一致性评价数据新增19个新报受理号,涉及13个品种,包括1个胶囊剂,6个片剂,6个注射剂。与上次统计周期相比,本次一致性评价申报品种与上周相同。
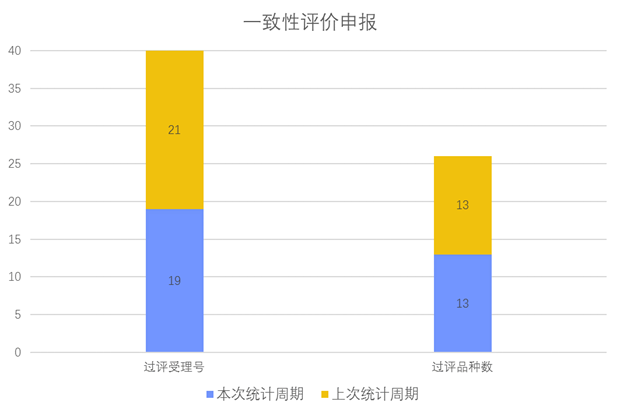
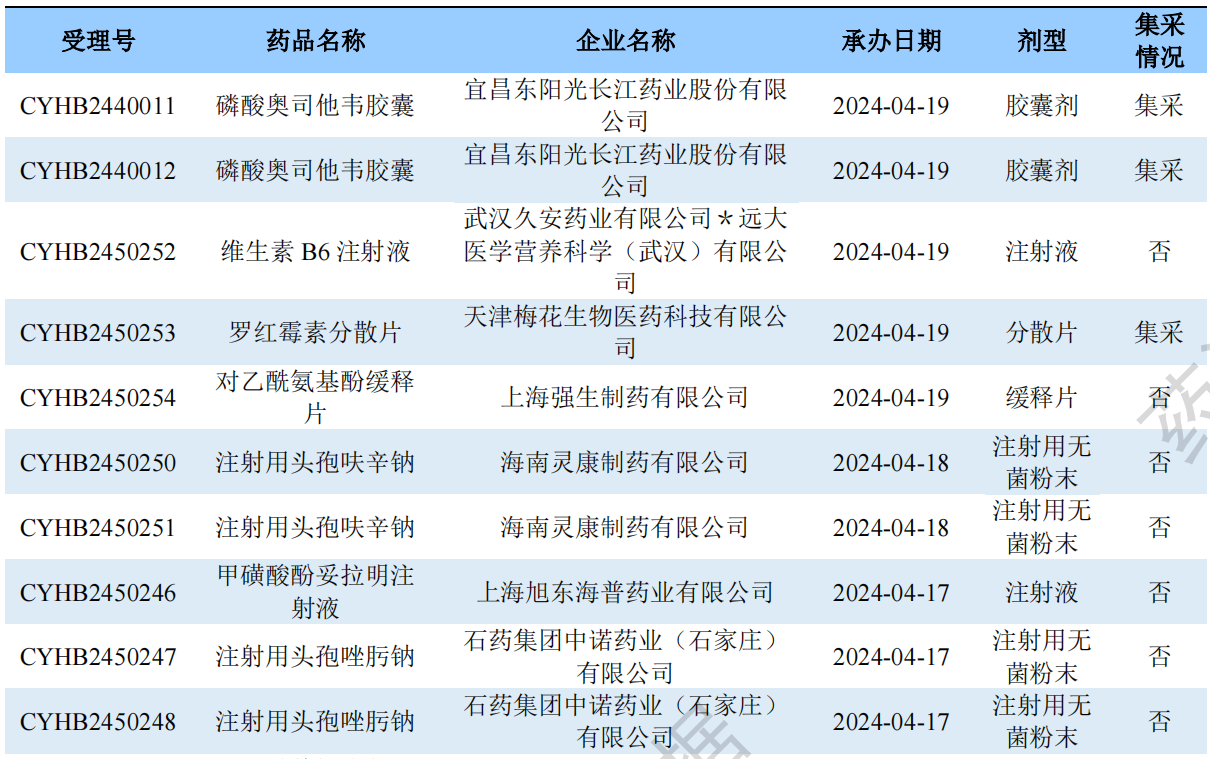
一致性评价申报受理情况(部分)
03
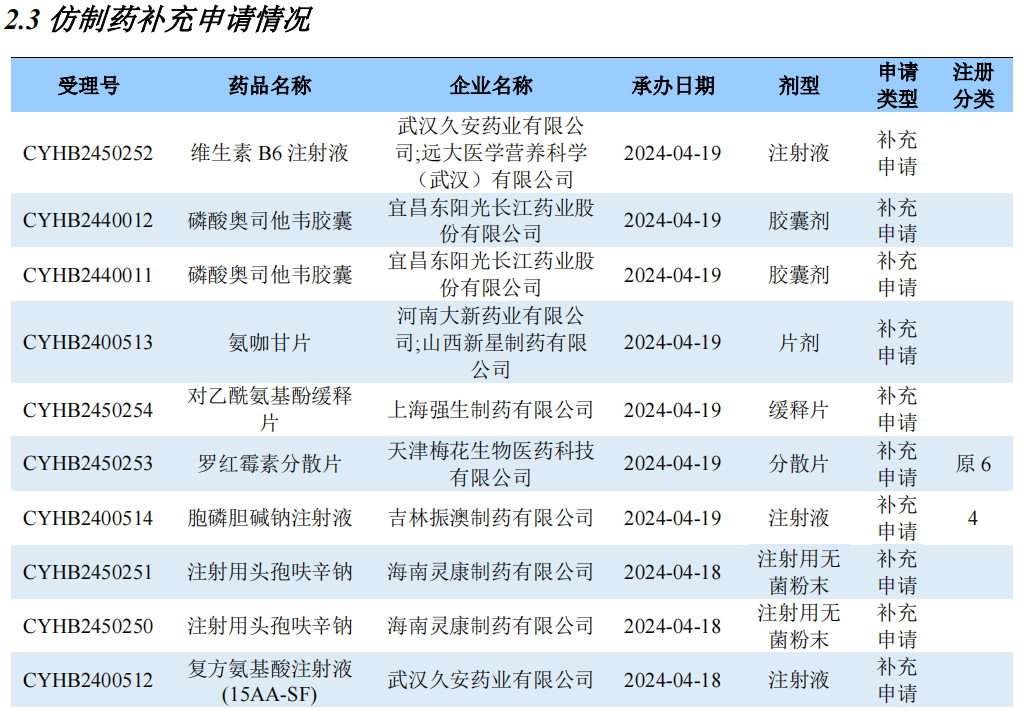
仿制药补充申请情况
04
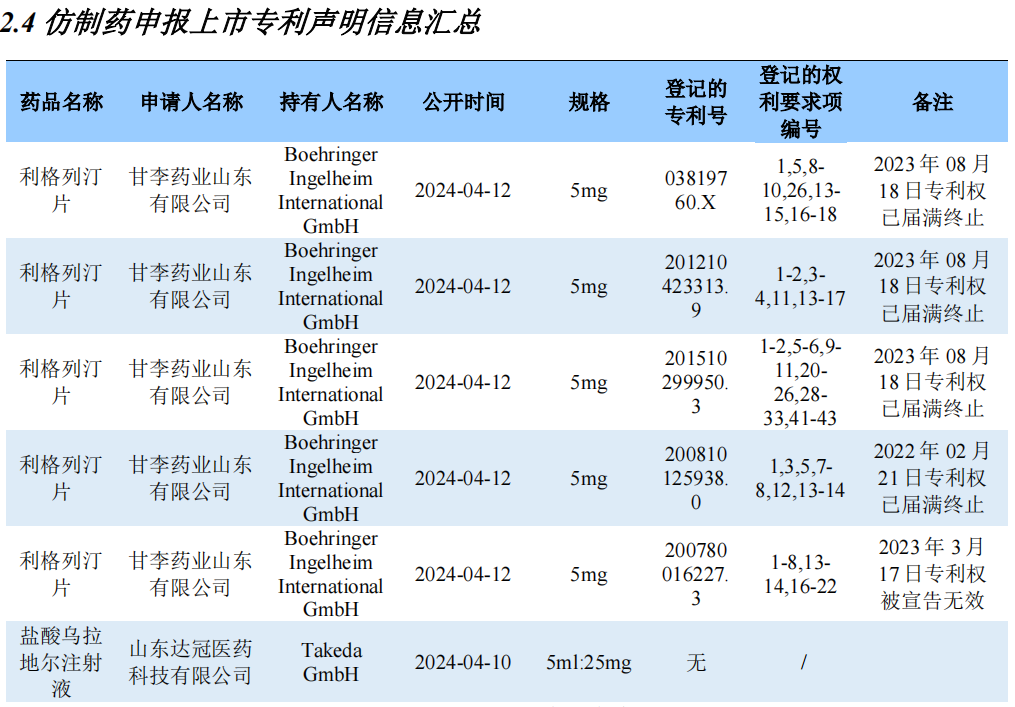
仿制药申报上市专利声明信息汇总
国内仿制药研发领域热点聚焦
01
国内仿制药研发领域政策法规相关动态
国家药监局关于发布仿制药参比制剂目录(第七十九批)的通告(2024年第14号)
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第七十九批)。特此通告。
02
国内仿制药研发领域热点新闻
国药现代:关于全资子公司获得药品注册证书的公告
2024 年4月16日,上海现代制药股份有限公司发布公告称,全资子公司国药集团容生制药有限公司于近日收到国家药品监督管理局核准签发的恩格列净片《药品注册证书》。现将相关情况公告如下:
一、药品基本信息
药品名称:恩格列净片
剂型:片剂
规格:10mg、25mg
注册分类:化学药品 4 类
证书编号:2024S00535、2024S00536
受理号:CYHS2300024 国、CYHS2300025
药品批准文号:国药准字 H20243456、国药准字 H20243457
上市许可持有人:国药集团容生制药有限公司
药品生产企业:国药集团容生制药有限公司
审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准注册。
二、药品研发及市场情况
恩格列净能减低肾脏将葡萄糖重新回收到血液中的能力,并将糖分经由尿液排出体外,有助于降低患者血糖水平。本品适用于治疗:(1)2 型糖尿病(10mg、25mg),用于改善 2 型糖尿病患者的血糖控制;(2)心力衰竭(10mg),用于症状性慢性心力衰竭成人患者,降低因心力衰竭住院的风险;(3)本品不建议用于 1 型糖尿病患者。
根据相关数据库显示,恩格列净片2023 年度在国内样本医院销售额为人民币 1.23 亿元。
根据 CDE 网站显示,除国药容生外,国内还有正大天晴药业集团股份有限公司、四川科伦药业股份有限公司、齐鲁制药(海南)有限公司等企业持有恩格列净片(10mg、25mg)药品注册证书。截止目前,国药容生用于开展该项目的累计研发投入约为人民币 1,107.00 万元(未经审计)。
三、对公司的影响及风险提示
本次国药容生获得恩格列净片药品注册证书并视同通过一致性评价,拓展了公司代谢及内分泌领域的糖尿病用药产品群,有利于进一步增强公司在代谢及内分泌领域的综合市场竞争力,为公司未来发展带来积极影响。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57