https://www.cphi.cn 2020-05-27 10:30 来源:CPhI制药在线 作者:滴水司南
在2020年5月23日周六,各大朋友圈、网络平台被一则"国家药品监督管理局核查中心官网发布公开征求《药品注册核查实施原则和程序管理规定(征求意见稿)》和《药品注册核查要点与判定原则(征求意见稿)》意见"的消息疯狂刷屏,备受药界人士的关注,这是历时12年之后的一次全面大修,新版《药品注册核查要点与判定原则(征求意见稿)》落实药品审评审批制度改革要求,贯彻实施新修订《药品注册管理办法》,坚持药品全体系的药品生产质量管理规范检查,代表着一个注册现场核查监管"新时代"的开启。
一、《药品注册核查要点和判定原则》前世今生
2008年,原国家食品药品监督管理局发布《关于印发药品注册现场核查管理规定的通知》(国食药监注〔2008〕255号),对药品注册现场核查的程序、要点和判定原则进行了规范,在国家药品监督管理局起草新《药品生产监督管理办法》的同时,国家药监局核查中心即着手研究修订药品注册核查要点和判定原则,2019年6月6日,核查中心组织部分省市药品注册、审评、核查等方面的专家研讨药品注册核查原则、标准和要求,研究借鉴国际经验,结合药品审评审批改革中药品注册核查的经验和做法,将药品注册现场核查的要点和判定原则分为药理毒理学研究、临床试验、生物等效性试验、药学研制和生产现场核查4种类型,从2008年首次发布《关于印发药品注册现场核查管理规定的通知》到2020年第一次修订间隔了将近12年。
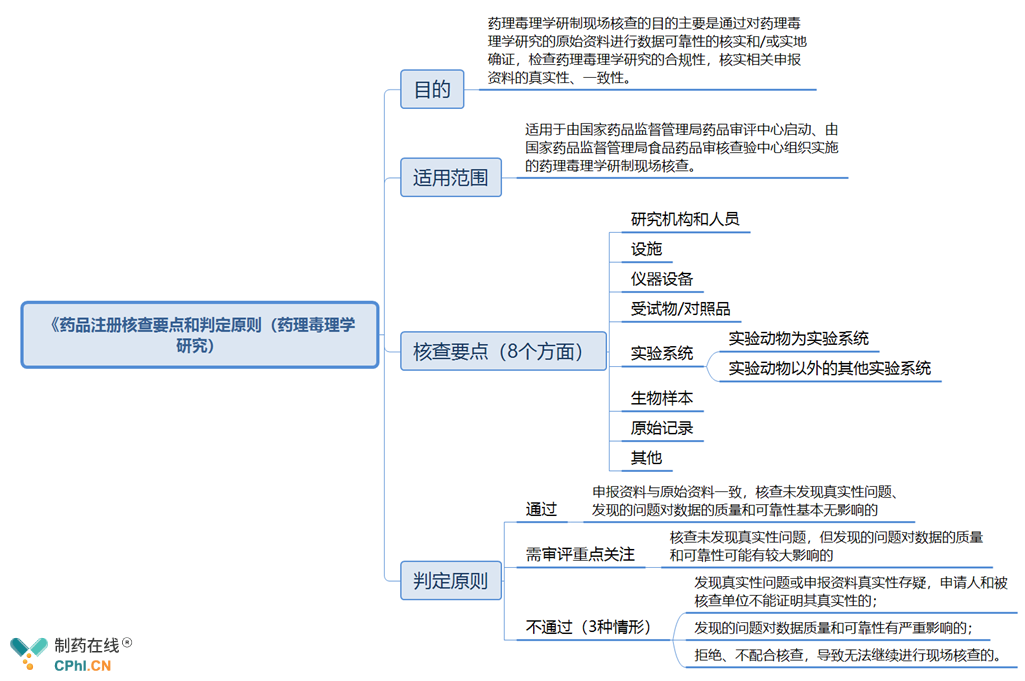
二、新版《药品注册核查要点和判定原则(药理毒理学研究)》主要内容抢先看
《药品注册核查要点和判定原则(药理毒理学研究)(征求意见稿)》分为4部分:
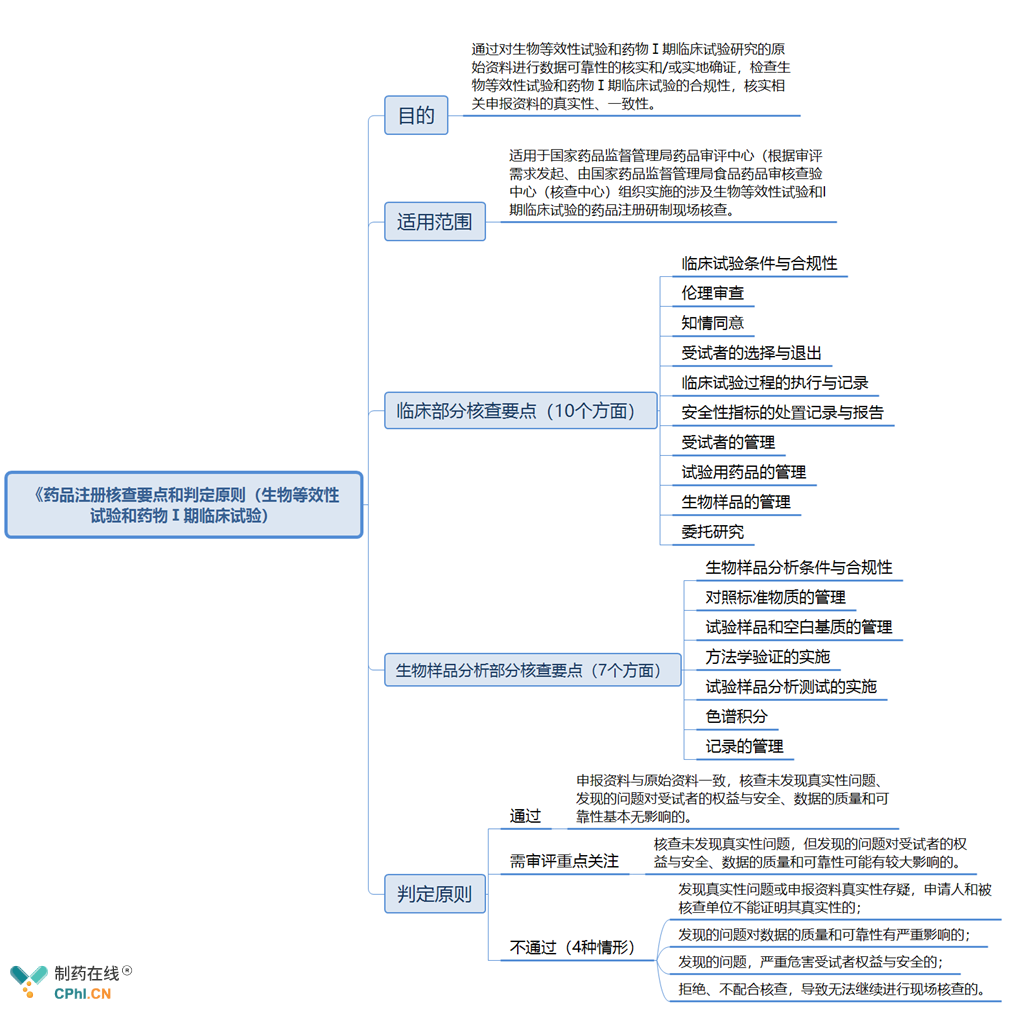
三、新版《药品注册核查要点和判定原则(生物等效性试验和药物Ⅰ期临床试验)》主要内容抢先看
《药品注册核查要点和判定原则(生物等效性试验和药物Ⅰ期临床试验)》分为4部分:
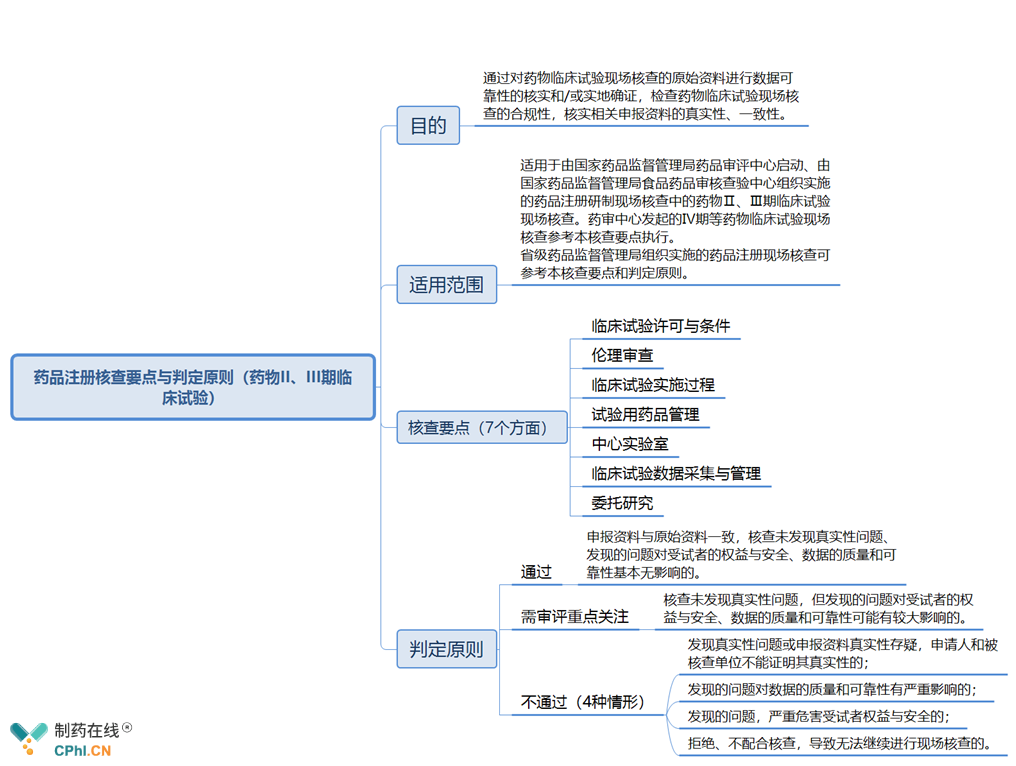
四、新版《药品注册核查要点与判定原则(药物II、III期临床试验)》主要内容抢先看
《药品注册核查要点与判定原则(药物II、III期临床试验)》分为4部分:
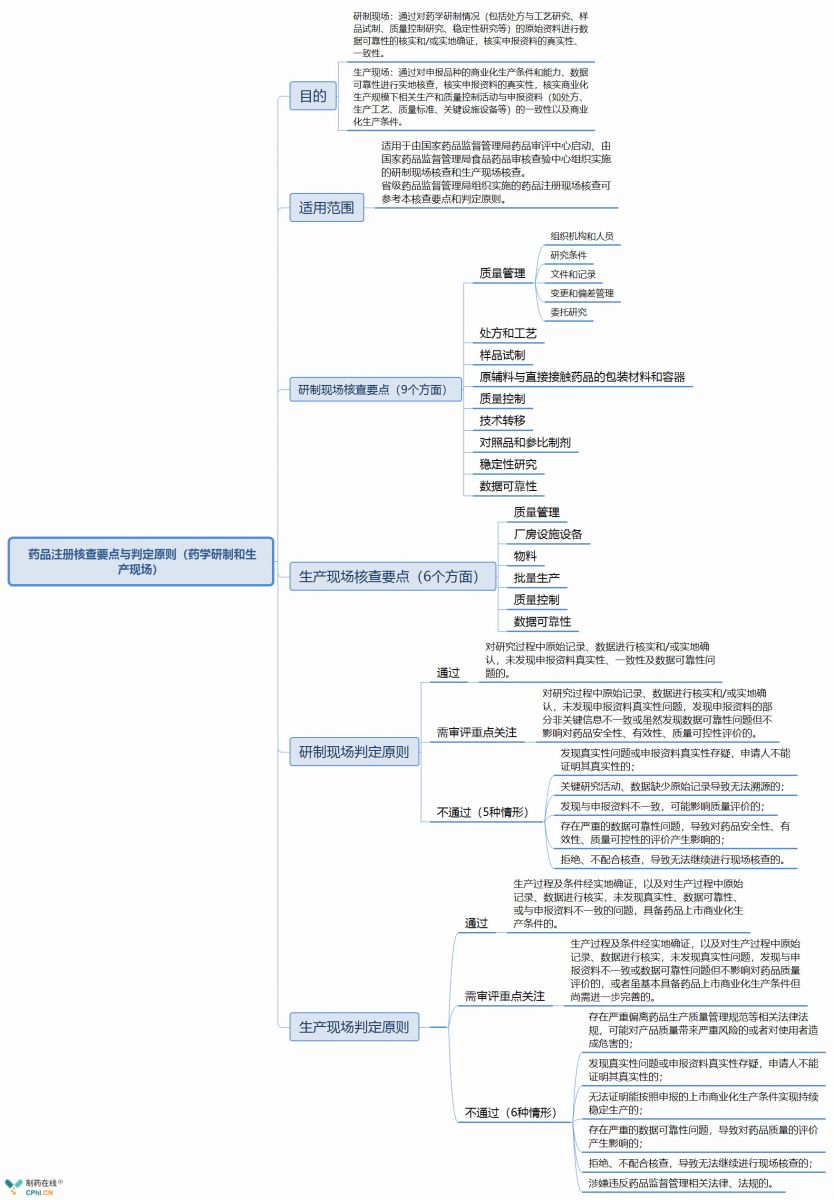
五、新版《 药品注册核查要点与判定原则(药学研制和生产现场)》主要内容抢先看
《 药品注册核查要点与判定原则(药学研制和生产现场)》分为6部分:
参考文献 [1] www.cfdi.org.cn/resource/news/12320.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030