https://www.cphi.cn 2020-06-03 12:02 来源:CPhI制药在线 作者:Dopine
乳腺癌是女性常见的恶性肿瘤,据统计我国每年大约有27万例新发女性乳腺癌患者,其中大约1/4是HER2(人表皮生长因子受体2)阳性。HER2阳性乳腺癌恶性程度比较高、进展比较快,曲妥珠单抗是目前HER2阳性乳腺癌助治疗、新辅助治疗和转移性治疗的标准一线方案。
曲妥珠单抗原研药是由罗氏研发的一款靶向HER2的人源化单克隆抗体,通过与HER2受体结合,能够精确治疗HER2扩增的乳腺癌患者,降低乳腺癌术后复发率,被誉为乳腺癌患者的救命药。1998年该药在美国获批上市,商品名为Herceptin,2000年在欧盟获批,2001年在日本获批,2002年在国内获批(商品名赫赛汀)。值得一提的是,2015年该原研药被列入世卫组织《基本药物示范目录》。
自上市后,Herceptin迅速成为罗氏的王牌产品,销售额多年稳居全球药品销售额排行榜前十位。但自2018年起,Herceptin销售额开始出现下滑,究其原因是因为生物类似物的冲击。
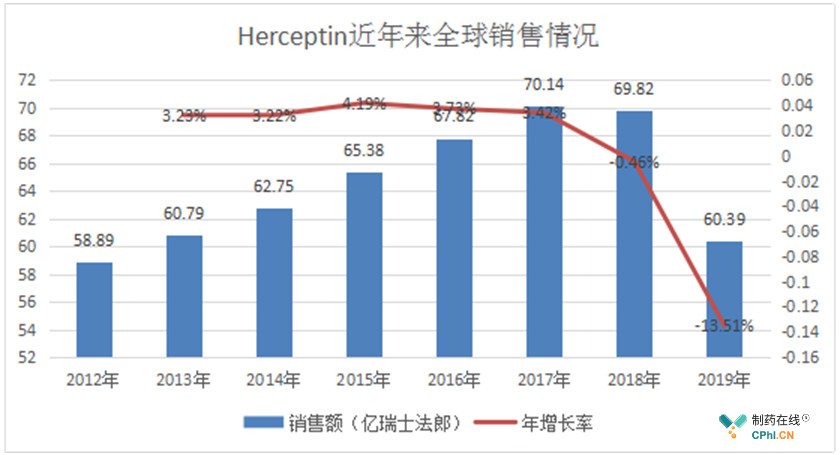
据悉Herceptin在欧洲和日本专利的于2014年到期,在美国的专利于2015年到期,目前FDA和EMA已经批准了多款赫赛汀生物类似物,详见下表。
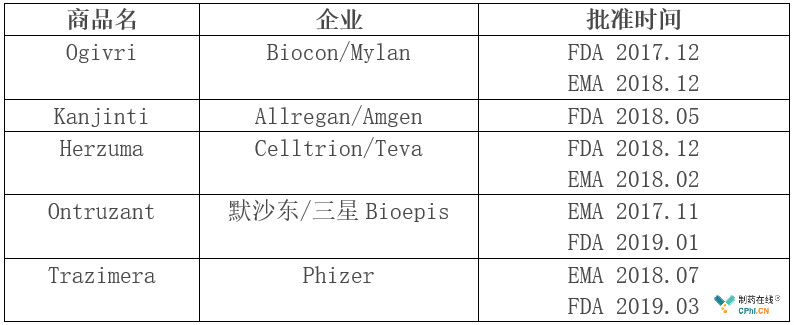
除了欧美市场,Biocon/Mylan合作开发的Herceptin类似药早在2013年11月获印度药品监管机构批准,韩国Celltrion公司的类似药Herzuma在2014年被韩国食品药品安全部(MFDS)批准。
值得一提的是,近日欧洲药品管理局(EMA)人用医药产品委员会(CHMP)发布积极审评意见,建议批准复宏汉霖HLX02(注射用曲妥珠单抗)用于治疗HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌以及未经治疗的HER2阳性转移性胃癌或胃/食管交界处腺癌的上市销售许可申请(MAA),预计欧盟委员会(EC)将参考CHMP的审评意见在未来2-3个月做出最终决定。若顺利获批,复宏汉霖HLX02将成为进入欧洲市场的第一个"中国籍"单抗生物类似药。
为了应对赫赛汀生物类似物的冲击,罗氏并没有坐以待毙,提前布局了Perjeta和Kadcyla,其中Perjeta即帕妥珠单抗,它也是一靶向HER2单克隆抗体,作用机制与赫赛汀相同,但结合部位不同(赫赛汀特异性结合到HER2蛋白在细胞膜外的第4个功能域(D4),阻断信号转导,介导细胞免疫作用对肿瘤杀伤,帕妥珠单抗特异性结合到HER2蛋白在细胞膜外的第2个功能域(D2),阻断HER2二聚化抑制HER2的激活),两者联用能够对HER2信号传导通路提供更全面的封锁,从而阻止癌细胞的生长和存活。而Kadcyla(T-DM1,Trastuzumab Emtansine)是一款抗体偶联药物,即能结合到微管蛋白的细胞**化合物Maytensine通过硫醚键共价结合到曲妥珠单抗上,利用后者对HER2的亲合作用,T-DM1与HER2蛋白结合后被肿瘤细胞内吞,细胞内的溶酶体将曲妥珠蛋白降解,未被降解的毒素Maytensine与微管蛋白结合从而杀伤肿瘤细胞。
此外罗氏还推出了赫赛汀皮下注射剂型Herceptin Hylecta,它是一种即用型制剂,可在2-5分钟内完成给药,较传统静脉输注剂型赫赛汀患者依从性更好。
在国内,2017年11月,CDE发布《注射用曲妥珠单抗生物类似药临床研究设计及审评考虑要点》公开征求意见,结合该品种特点细化仿制策略,鼓励更多中国本土企业积极研制Herceptin生物类似药。
但目前,国内还没有任何一款曲妥珠单抗生物类似物获批。为保住市场份额,罗氏采取降价策略,2017年赫赛汀的价格由每支的24500元降至7600元,以近70%的降幅成功入围了国家医保目录,并通过持续降价成功续约2019年医保,而且罗氏的帕妥珠单抗也通过降价进入2019年医保。
据insight数据库,目前三生国健和复宏汉霖均已递交了曲妥珠单抗的上市申请,据相关受理号的审评时光轴,三生国健略复宏汉霖,有望率先拿下曲妥珠单抗生物类似物。其实三生国健早在2011年4月就提交曲妥珠单抗-302H的上市申请,但后来因被纳入《药物临床试验数据自查核查名单》,2016年5月三生国健主动撤回该药品的上市申请。

曲妥珠单抗-HLX02若能顺利获批上市将对三生国健来说具有重大意义,因为三生国健现有的两款的抗体类药物--益赛普(注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白)和健尼哌(重组抗CD25人源化单克隆抗体注射液)分别于2005年和2011年获批,三生国健已将近有10年未有新产品获批,其中益赛普是三生国健的主要收入来源,但却面临着激烈的市场竞争,目前国内已有多款TNF-α抑制剂获批上市,且益赛普的专利保护期将在2021年到期,届时市场竞争会更加激烈。健尼哌据悉去年10月份才开始上市销售,用于预防肾移植引起的急性排斥反应,2019年度销售收入约190.23万元,预计后期将迎来放量过程。
不过,令人担忧的是,由于三生国健的招股书中关于"302H"项目描述使用的通用名是"伊尼妥单抗",不知获批后会不会影响直接进入医保。
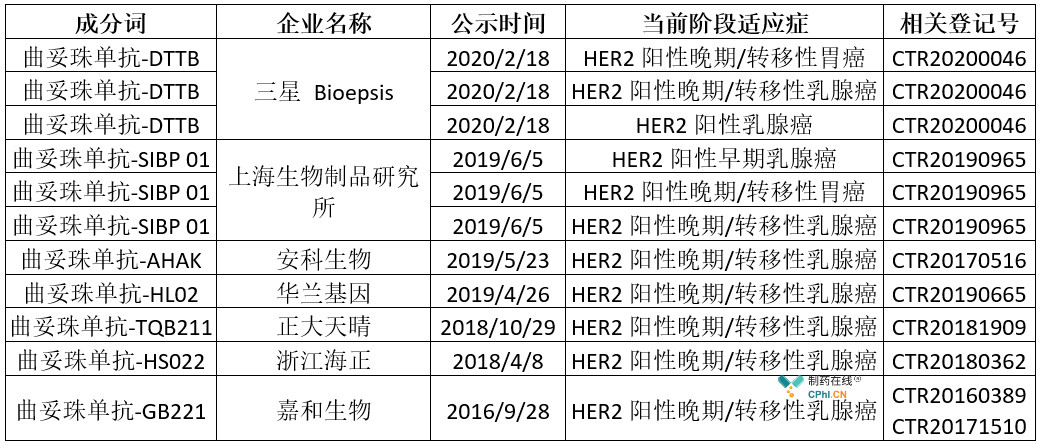
此外,据insight数据库,三星Bioepsis、上海生物制品研究所、安科生物、华兰基因、正大天晴、浙江海正等企业处于III期临床阶段,预计未来国内曲妥珠单抗市场的竞争将会愈发激烈。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030