10月12日,美国FDA细胞、组织和基因疗法咨询委员会(CTGTAC)会议讨论了星火疗法公司(Spark Therapeutics)提交的voretigene neparvovec(Luxturna)产品上市许可申请,专家组一致认为Luxturna益大于弊。FDA的最终决定,预计将于2018年1月12日公布。
RPE65基因在视觉循环中有着重要的作用,该基因突变后损害了眼睛对光线的反应能力,最终导致视网膜上的光感受器被破坏。
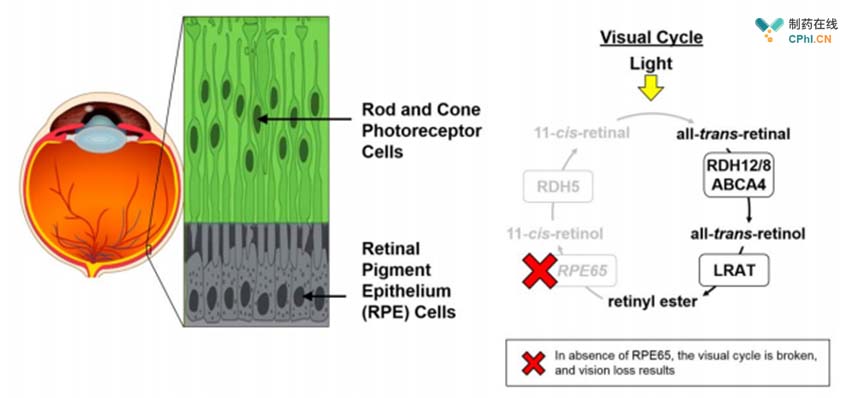
RPE65在视觉循环中的重要作用
[图片来源:FDA Briefing_Document_Spark_LUXTURNATM_CTGTAC_10-12-2017]
Luxturna的设计目的是治疗患有RPE65基因突变的个体。星火疗法公司Luxturna包括一种携带RPE65基因正常拷贝的病毒。病毒被注入到眼睛里,在那里表达基因,并提供RPE65蛋白的正常拷贝。
Luxturna的主要临床结果
Luxturna治疗的结果与对照组相比,在治疗后的30天内在光敏感性和视觉功能方面有显著的和统计学意义上的显著改善;临床一期的研究显示,在使用Luxturna治疗后,光敏感性的持续和持久的改善,大多数的研究对象在视觉功能和功能视觉方面至少有4年的进步;临床III期实验达到了预先指定的主要目标,在较低的光水平上显示了视觉功能的显著改善;视觉功能问卷和基于社区的功能视觉评估建议表明,在使用Luxturna治疗后,日常活动得到了改善;在Luxturna治疗的临床III期对照实验中,在公司收集数据的整整一年时间里,视觉功能得到了持续改进,同时,对照组的总体表现没有任何改善。Luxturna在临床III期的长期疗效已经持续跟踪了3年,目前,还在进行中。
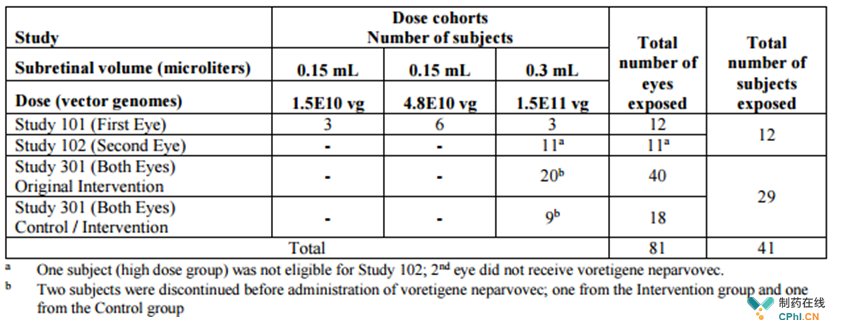
临床I期和临床III期样本数量和剂量选择
[图片来源:FDA Briefing_Document_Spark_LUXTURNATM_CTGTAC_10-12-2017]
Luxturna的临床安全性
总的来说,在长达9年的临床I期和3年的临床III期安全性跟踪中,受试者眼睛都有出现了不良反应(AEs),并且随着时间的推移会逐渐减少和消失。85%的AEs报告都是轻微或中等强度的,9名受试者出现了14个SAEs报告,其中六名受试者经历了严重的AEs。有73%的受试者报告了单眼的AEs。以最小或不干预的方式来解决大多数人出现的AEs,发现没有任何后遗症。在临床和长期跟踪中没有报告死亡病例。
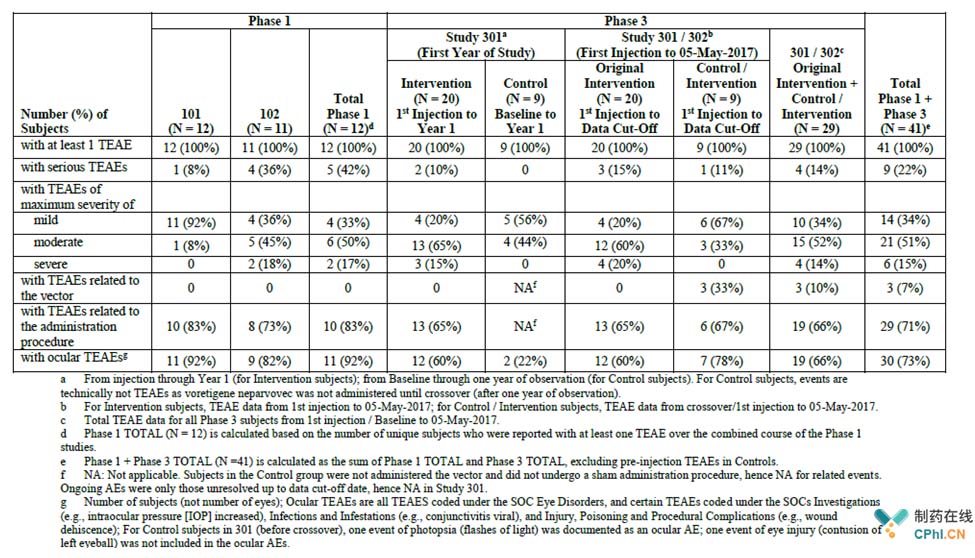
Luxturna临床期间不良反应总览
[图片来源:FDA Briefing_Document_Spark_LUXTURNATM_CTGTAC_10-12-2017]
基因治疗之病毒介导的基因置换
Luxturna应用的这种基因疗法被被称为病毒介导的基因替换,即通过转换方式完成基因替换,以病毒为载体,将外源目的基因通过基因重组技术,将其组装于病毒上,让这种重组病毒去感染受体宿主细胞,这种病毒称为病毒运载体(viralvector)。
从2007开始,总共有三支团队开始利用RPE65蛋白进行基因疗法的临床I期试验,但在2015年早些时候,这三支团队中有两支球队都遭遇了挫折。原因是因为,在治疗结束一年后,一些患者的效果逐渐减弱。而唯一仅存的Spark表示,在治疗后的8年里还没有看到任何患者的下降。这一结果让Spark的治疗成为一种优势。Spark首席科学官指出,Spark设计的病毒可能在特别高的水平上表达了RPE65,另外注射时添加了一种表面活性剂分子或许对实验结果有着重要影响。
8月30日,FDA批准了诺华的世界首款CAR-T疗法Kymriah(Tisagenlecleucel,CTL019),即免疫细胞用于对抗癌症的治疗方法。与Spark的治疗不同,癌症治疗并不针对特定的致病突变,而是针对从人体中移除的免疫细胞进行管理,然后再进行再注入。因此,一旦Luxturna获得批准,将是基因治疗首次用于由基因突变引起的疾病,将是继诺华CAT-T后又一里程碑突破,让我们共同期待继CAR-T后在2018年基因治疗喜报连连!!!
来源:FDA Briefing_Document_Spark_LUXTURNATM_CTGTAC_10-12-2017



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57