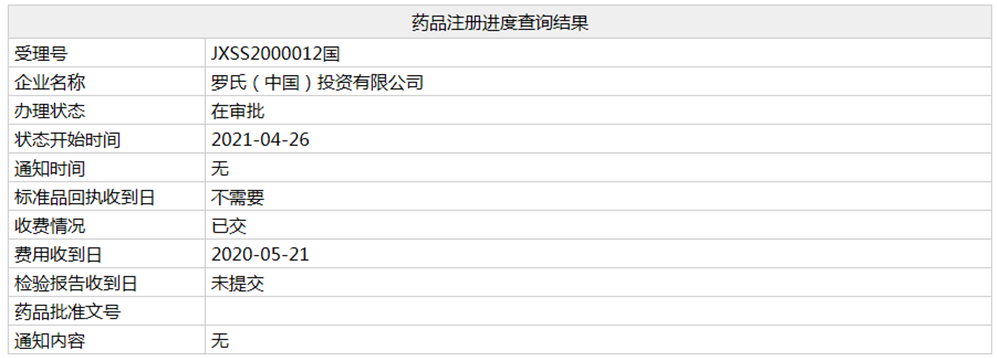
近日,罗氏药业「艾美赛珠单抗注射液」在国内的第二个上市申请(相关受理号为JXSS2000012/13/14/15)进入行政审批阶段,预计不日将正式获批,新适应症为:用于不存在凝血因子VIII抑制物的A型血友病患者(先天性凝血因子VIII缺乏)成人和儿童患者的常规预防性治疗以防止出血或降低出血发生的频率。
血友病是一种遗传性凝血障碍疾病,主要分为A、B两种类型,其中A型血友病最为常见,约占全部血友病的80%~85%。A型血友病患者血浆中缺乏凝血因子Ⅷ,导致血管破裂后血液不易凝结,出血时间延长。临床上,A型血友病主要采取凝血因子Ⅷ替代治疗,但是约15%-25%血友病A患者经凝血因子Ⅷ替代治疗后,体内出现凝血因子Ⅷ抑制物,常规治疗无效,出血风险增加。在国内,血友病被列入2018年5月国家卫生健康委员会等5部门联合制定的《第一批罕见病目录》。
艾美赛珠单抗(emicizumab,Hemlibra)是由罗氏旗下中外制药(Chugai Pharmaceutical)研发的一款靶向凝血因子IXa和X的重组人源化IgG4双特异性单克隆抗体,通过桥接凝血因子IXa和凝血因子X,在体内模拟凝血因子VIIIa以恢复A型血友病患者的凝血功能。
2017年11月,Hemlibra在美国被FDA批准作为一种常规预防性 药物,用于体内已产生凝血因子VIII抑制剂的A型血友病成人及儿童患者,降低出血事件发生率,2018年2月该适应症在欧洲获批。2018年10月,该药又被FDA批准作为一种常规预防性治疗药物,用于体内未产生凝血因子VIII抑制剂的A型血友病成人、儿童、新生儿及老年人患者,预防或降低出血事件的发生频率,2019年3月该适应症在欧洲获批。
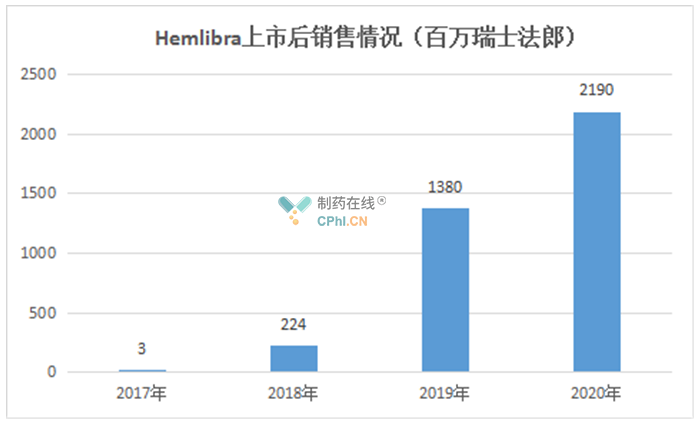
截至目前,Hemlibra已在全球90多个国家被批准用于治疗体内存在因子VIII抑制剂的A型血友病A患者,在全球80多个国家被批准用于治疗体内不存在因子VIII抑制剂的A型血友病患者,大约8200例患者接受了Hemlibra治疗。据公司财报,Hemlibra上市后销售额逐年攀升,2020年达到21.9亿美元。
在国内,艾美赛珠单抗于2018年11月被NMPA批准用于存在凝血因子VIII抑制物的A型血友病患者(先天性凝血因子VIII缺乏)的常规预防性治疗,以防止出血或降低出血发生的频率,商品名为舒友立乐,成为国内批准的首 个双特异性抗体。艾美赛珠单抗新适应症一旦获批,将有望进一步扩大适应症人群,覆盖更多A型血友病患者。不过遗憾的是,艾美赛珠单抗因为价格因素未成功进入国家医保。
多款A型血友病新药迎来新进展
近年来国外多款A型血友病新药迎来新进展,如赛诺菲的efanesoctocog alfa、BioMarin的Roctavian(valoctocogene roxaparvovec,BMN270)、Sangamo Therapeutics/辉瑞的giroctocogene fitelparvovec(SB-525或PF-07055480)、辉瑞的marstacimab(PF-06741086)等。
efanesoctocog alfa(前称BIVV001,rFVIIIFc-VWF-XTEN)是基于创新的Fc融合技术开发的一种新型融合蛋白,通过添加血管性血友病因子(vWF)的一个区域和XTEN?多肽来延长其在血液循环中的时间。该药独立于vWF,有潜力在一周的大部分时间内提供接近正常的出血保护,半衰期的增加可能使预防性治疗的给药频率降低到每周一次,有望改变A型血友病患者的因子替代疗法治疗,2021年2月被FDA授予治疗A型血友病的快速通道资格。
Roctavian是一种使用AAV5病毒载体递送表达凝血因子VIII的转基因的基因疗法。2021年1月,BioMarin宣布该药治疗重症A型血友病全球性III期研究( GENEr8-1)取得积极顶线结果,数据显示:单剂量valoccogene roxaparvovec可显着降低年化出血率(ABR)达84%,患者年出血事件发生次数由前期收集的4.8次(中位值2.8)降低至0.8次(中位值0.0) (p<0.0001),80%受试者在接受治疗5周后不再出现出血症状。而且,valoctocogene roxaparvovec降低受试者FVIII年输注率达99%。患者FVIII年输注次数由135.9次 (中位值128.6) 降低至 2.0 次(中位值0.0) (p<0.0001)。接受valoctocogene roxaparvovec治疗1年后,mITT人群(n=132)使用显色底物(CS)法测量的平均内源性FVIII表达水平为43.6 (SD 45.3,中位值24.2) IU/dL,该检测结果支持临床观察到的出血现象的减少和FVIII输注率的降低。去年8月,该药的额BLA惨遭FDA拒绝,FDA拒绝了该药的
marstacimab(PF-06741086)是一种靶向组织因子途径抑制物(TFPI)Kunitz域的人单克隆免疫球蛋白IgG1,被开发作为一种预防性治疗方法,用于预防或减少重度A型血友病和B型血友病患者出血发作的频率。marstacimab有望提供一种改善血液凝固的新方法,已公布的2期研究结果显示其有潜力通过皮下注射改善出血控制,并可能消除预防性因子替代疗法的需要,去年10月该药进入三期临床。
SB-525是一款基于重组AAV6载体的基因疗法,其设计对肝 脏特异性启动子、编码因子VIII的转基因,以及polyA和病毒载体序列都作出了改进,不但能够优化载体生产的效率,还提高肝 脏特异性因子VIII蛋白的表达。2020年6月该药治疗重度A型血友病的1/2期临床研究Alta取得积极结果,数据显示:接受3e13 vg/kg剂量giroctocogene fitelparvovec的5名重度A型血友病患者均表现出持续的VIII因子(FVIII)活性水平,通过显色测定(输注9周后患者体内FVIII水平平均值)的中位数为64.2%,没有患者出现出血事件或需要注射FVIII。SB-525由Sangamo研发,2017年辉瑞与Sangamo就该药达成一项独家全球合作及授权协议。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57