本周看点
1.首 个国产新冠中和抗体联合疗法获批!
2.恒瑞医药「卡瑞利珠单抗」获批2项新适应症
3.海思科「环泊酚」获批第3项适应症
4.一力制药中药1类新药虎贞清风胶囊即将获批
本期(12月3日至12月10日),我国迎来首 款新冠中和抗体联合疗法;恒瑞医药卡瑞利珠单抗再斩获两项新适应症,目前已有8项适应症获批上市;海思科镇静**创新药环泊酚获批第3项适应症,更多动态如下:
国内审评审批·新动态
本周CDE有33个受理号(23个品种)报生产办理状态更新,其中恒瑞医药的注射用卡瑞利珠单抗、海思科的环泊酚注射液、一力制药的虎贞清风胶囊备受关注,此外,国家药品监督管理局应急批准了国家药监局应急批准了腾盛博药的新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)上市。更多动态如下:
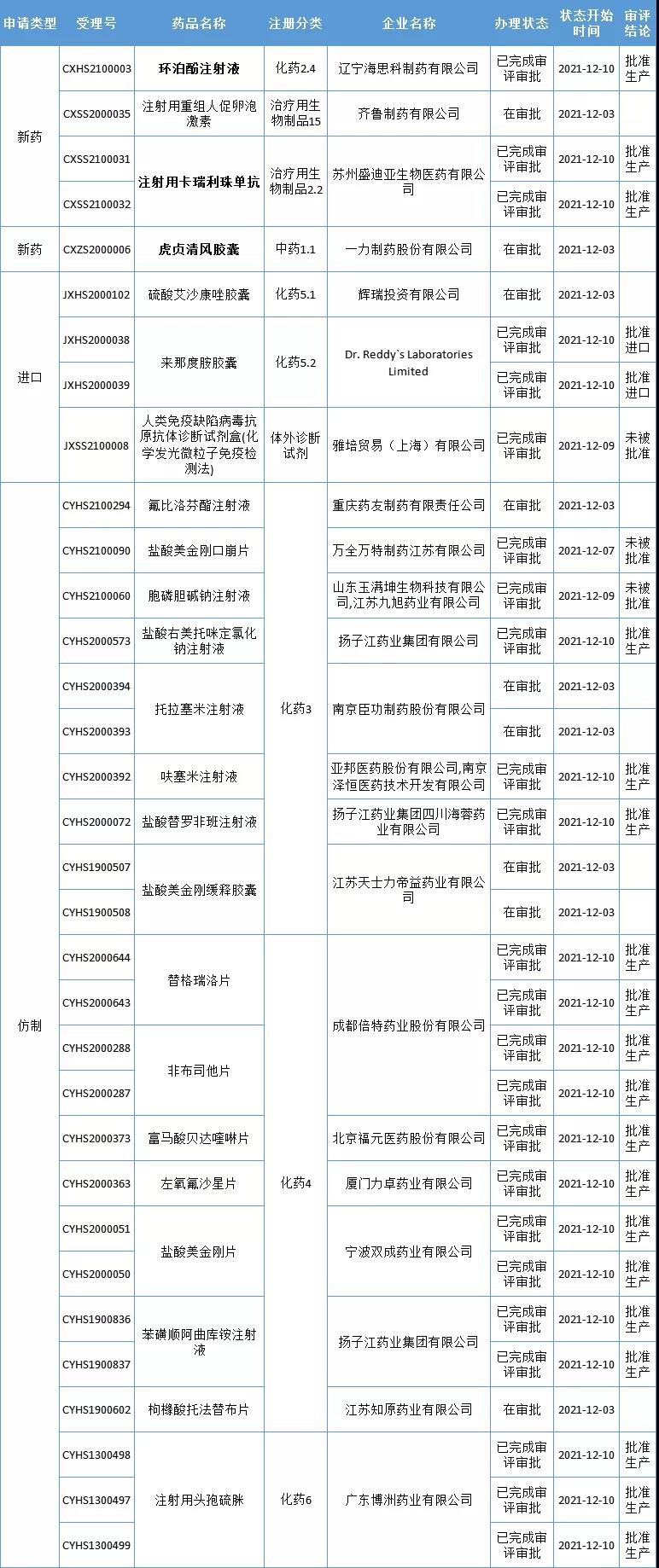
数据来源:药智数据
恒瑞PD-1获批两项新适应症
恒瑞医药的PD-1抑制剂卡瑞利珠单抗又有两项新适应症上市申请获得批准,分别为:联合紫杉醇和顺铂用于晚期食管癌一线治疗,及联合化疗用于晚期或转移性鳞状非小细胞肺癌(NSCLC)患者一线治疗。
注射用卡瑞利珠单抗是恒瑞医药自主研发的人源化抗PD-1单克隆抗体,自2019年5月上市以来,该产品已先后获批8项适应症,包括:
①三线治疗经典型霍奇金淋巴瘤
②二线治疗晚期肝细胞癌
③单药二线治疗晚期食管鳞癌
④联合培美曲塞和卡铂一线治疗晚期或转移性非鳞癌非小细胞肺癌
⑤三线治疗复发/转移性鼻咽癌
⑥联合顺铂和吉西他滨一线治疗鼻咽癌
⑦联合紫杉醇和顺铂一线治疗食管癌
⑧联合化疗一线治疗鳞状非小细胞肺癌(NSCLC)
其中前四项适应症已纳入医保。
此外,恒瑞开发的第二代PD-1抗体也已进入临床。12月8日,恒瑞医药皮下注射PD-1抗体SHR-1901在药物临床试验登记与信息公示平台网站登记了一项1期临床试验,旨在评估SHR-1901在晚期恶性肿瘤受试者中的安全性。
海思科「环泊酚」获批第3项适应症
药智数据显示,海思科环泊酚注射液第3项适应症已获NMPA批准上市。
环泊酚(HSK3486)是海思科开发的全新的具有自主知识产权的静脉**药物。该药是经典**镇静药丙泊酚的改良型新药,其效能显著高于丙泊酚,且安全性好于丙泊酚。
目前,环泊酚已申报 5 项适应症,其中“消化道内镜检查中的镇静”及“全身**诱导”适应症分别于 2020 年 12 月、2021 年 2 月获得国家药品监督管理局批准上市;本次获批适应症为以下3 项之一:“支气管镜诊疗的镇静和/或**”、“全身**诱导和维持”及“重症监护期间的镇静” 。此外,环泊酚正在中国开展“妇科门诊手术”适应症的Ⅲ期临床试验,正在美国开展“**诱导”适应症的Ⅲ期临床试验。
根据12月3日公布的《国家医保目录(2021版)》,环泊酚经国家谈判被纳入医保。
一力制药中药1类新药虎贞清风胶囊即将获批
药智数据显示,一力制药的1.1类中药新药虎贞清风胶囊上市申请已进入行政审批阶段。据悉,该药已于今年6月完成了生产现场检查,或将于近日获批上市。
今年以来,已有多个中药创新药获批上市。其中康缘药业的银翘清热片是自2020年7月1日新的中药注册分类实施以来,首 个获批上市的1.1类中药;11月,国家药监局还批准了方盛制药的玄七健骨片、凤凰制药的芪蛭益肾胶囊和天士力的坤心宁颗粒上市。一力制药的虎贞清风胶囊也有望于近日获批。
首 个国产新冠中和抗体联合疗法获批!
2021年12月8日,国家药监局应急批准了腾盛博药的新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)上市,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40 kg)新型冠状病毒感染( COVID-19)患者。其中青少年(12-17岁,体重≥40 kg)适应症人群为附条件批准。
安巴韦单抗和罗米司韦单抗是腾盛博药与深圳市第三人民医院和清华大学合作从新型冠状病毒肺炎(COVID-19)康复期患者中获得的非竞争性新型严重急性呼吸系统综合症病毒2(SARS-CoV-2)单克隆中和抗体。
这是中国 第一家获批的自主知识产权新冠病毒中和抗体联合治疗药物。根据ACTIV-2试验3期结果,与安慰剂相比,这一联合疗法使临床进展高风险的COVID-19门诊患者住院及死亡复合终点降低80%。
此外,腾盛博药已完成向美国食品药品监督管理局(FDA)提交安巴韦单抗/罗米司韦单抗联合疗法的紧急使用授权(EUA)申请,还在全球其它成熟和新兴市场积极推进安巴韦单抗/罗米司韦单抗联合疗法的注册申请工作。
国内审评审批·新受理
本周CDE新增报生产受理号61个,共42个品种,大批仿制药提交上市申请,更多动态见下表:
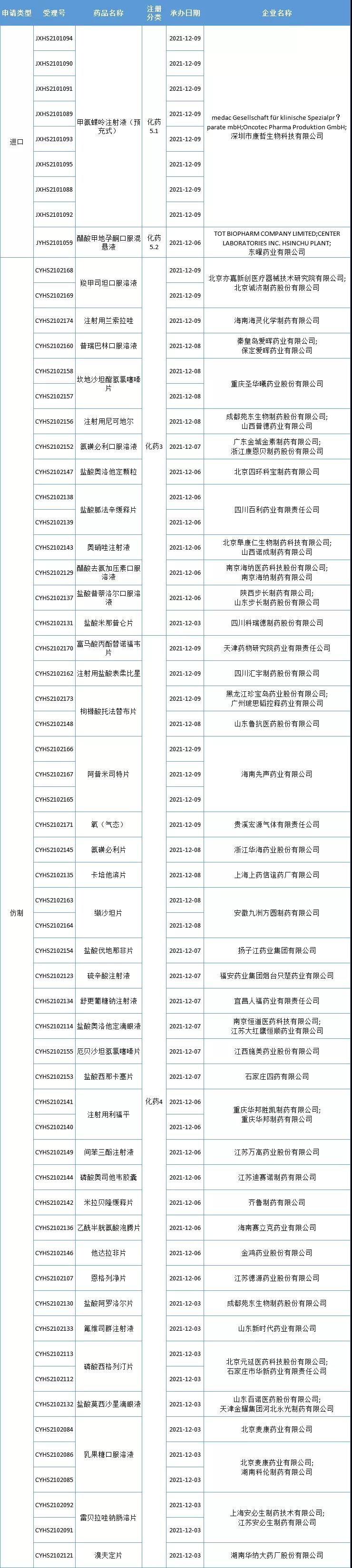
数据来源:药智数据








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57