根据药智数据最新统计,2023年1月份CDE共承办新的药品注册申请以受理号计有1335个,其中化药受理957个,中药受理194个,生物制品受理184个;2023年1月各类药品注册申请受理情况详见图1。

图1 2023年1月CDE药品受理情况
数据来源:药智数据,药智咨询整理
2023年1月份<注:状态开始时间(药智)从2023年1月1日至2023年1月31日>完成审评的受理号共1031个,其中化药受理678个,中药受理173个,生物制品受理174个;2023年1月各类药品完成审评情况详见图2。

图2 2023年1月CDE药品完成审评情况
数据来源:药智数据,药智咨询整理
以下且看化药、中药、生物制品的注册受理及审评情况详细分析。
一、化药申报与审评情况
(一)化药受理情况
1月份CDE承办新的化药注册申请957个(以受理号计),其中新药申请受理号154个,进口受理号52个,仿制申请受理号280个,补充申请421个,进口再注册44个;
以审评任务类别统计(以受理号计),IND申请152个,ANDA申请277个,NDA申请30个,进口再注册申请44个;2023年1月CDE化药各审评任务类别申请受理情况详见图3。

图3 2023年1月CDE化药各审评任务类别申请受理情况
数据来源:药智数据,药智咨询整理
1.化药1类国产申报情况
1月CDE受理化药国产1类新药共计121个(按受理号计),其中IND申请109个,涉及56个品种(按药品+企业维度统计),NDA申请12个,涉及7个品种(按药品+企业维度统计),目前均已进入相应序列排队待审;下表为1月新承办的1类国产新药。
表1 2023年1月新承办的化药1类国产新药

注:排队序号截止至2023年02月02日
数据来源:药智数据,药智咨询整理
2.化药1类进口药品申报情况
1月共17个进口化药1类受理号获得承办,其中IND申请14个,NDA申请3个,共12个品种,目前均已进入相应序列排队待审;下表为1月新承办的1类进口新药。
表2 2023年1月新承办的化药1类进口新药
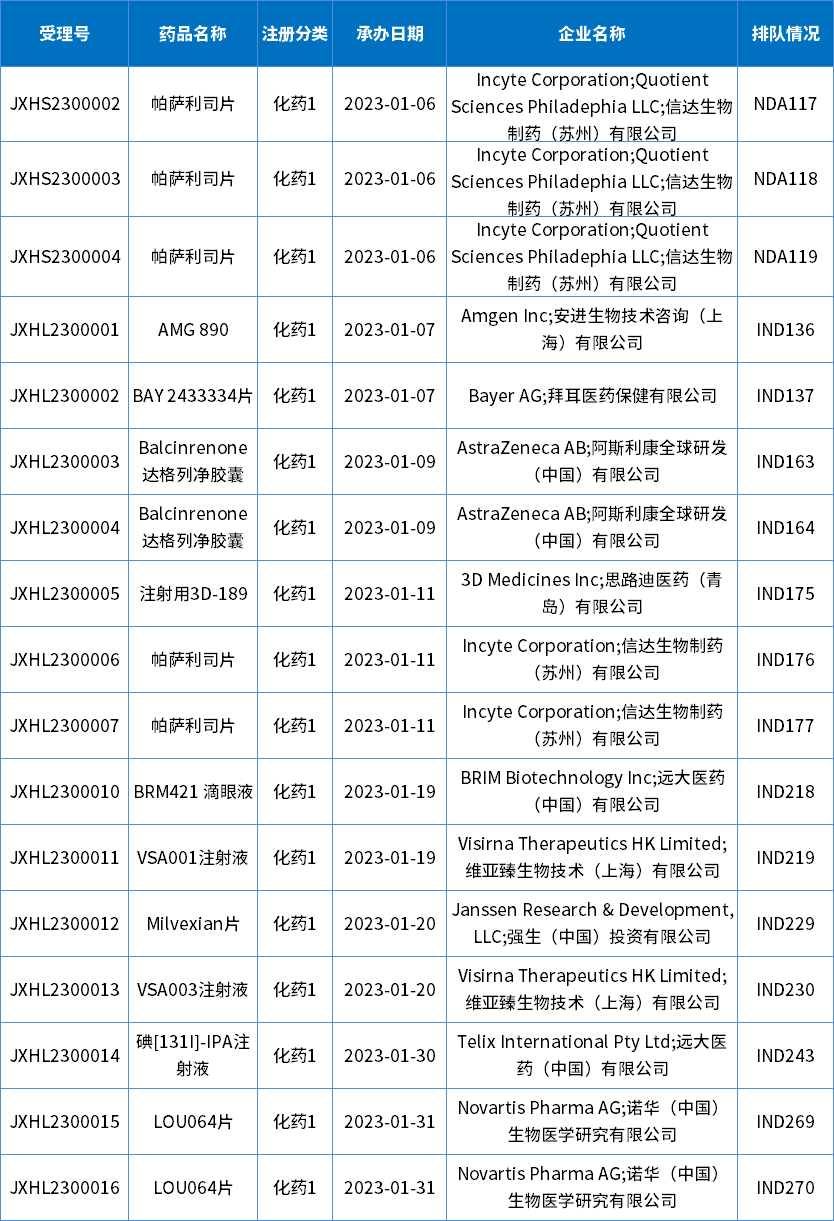
注:排队序号截止至2023年02月02日
数据来源:药智数据,药智咨询整理
HSK40118片
HSK40118是海思科自主研发的口服EGFR-PROTAC小分子抗肿瘤药物,临床拟用于治疗EGFR突变的晚期非小细胞肺癌。
TUL01101片
TUL01101是珠海联邦制药研发的具有自主知识产权的小分子JAK1抑制剂,拟用于治疗轻、中度特应性皮炎。
APL-1401胶囊
APL-1401是江苏亚虹医药自主研发的一种全新机制治疗溃疡性结肠炎(UC)的口服创新药物。APL-1401是一种多巴胺β-羟化酶(DBH)抑制剂,能够提高多巴胺(DA)并降低去甲肾上腺素(NE)浓度,使肠道免疫稳态恢复正常。APL-1401的开发有望给UC患者提供新的治疗手段。
3.化药改良型新药申报情况
1月新增化药2类改良型新药37个(按受理号计),其中IND申请28个,NDA申请9个,共涉及23个品种;2023年1月CDE化药改良型新药申请受理情况详见图4。

图4 2023年1月CDE化药改良型新药申请受理情况
数据来源:药智数据,药智咨询整理
(二)化药完成审评情况
1月份CDE完成审评的化药注册申请678个(以受理号计),其中新药申请受理号96个,进口受理号51个(其中包含8个一次性进口),仿制申请受理号152个,补充申请357个;以审评任务类别统计(以受理号计),IND申请123个,ANDA申请143个,NDA申请10个,进口再注册申请22个,一致性评价81个;2023年1月CDE化药各审评任务类别完成审评情况详见图5;
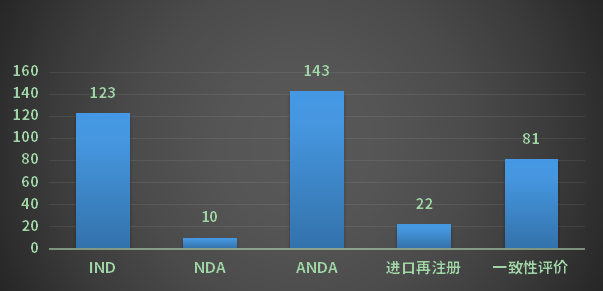
图5 2023年1月CDE化药各审评任务类别完成审评情况
数据来源:药智数据,药智咨询整理
以受理号审评结论来看,其中批准临床160个,批准生产121个,批准进口6个,未被批准23个;2023年1月CDE化药化药完成审评结论情况详见图6;
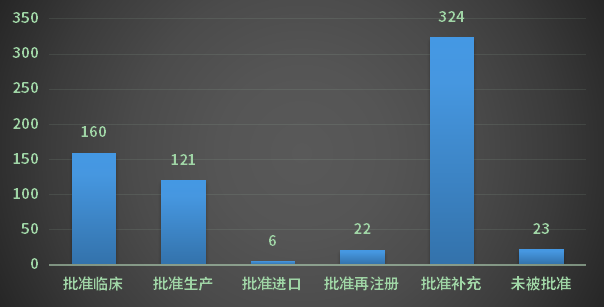
图6 2023年1月CDE化药化药完成审评结论情况
数据来源:药智数据,药智咨询整理
1.化药新药获批情况
1月批准的新药和进口原研共4个,包括:1个1类新药、2个进口原研和1个增加新适应症的改良型新药批准上市,其中;下表为1月化药批准上市新药信息。
表3 2023年1月化药获批新药信息
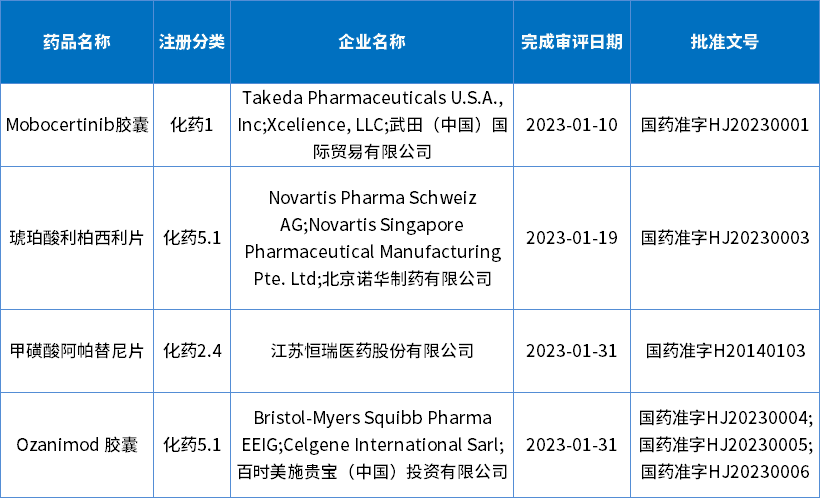
数据来源:药智数据,药智咨询整理
Mobocertinib胶囊
Mobocertinib胶囊(琥珀酸莫博赛替尼胶囊)是武田制药研发1类新药,是一种靶向EGFR第20外显子插入突变的不可逆的酪氨酸激酶抑制剂,该药适用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
2.化药仿制药获批情况
1月共76个化药仿制药批准上市(按药品名+企业维度统计,排除了“氧”的数据统计),其中注册分类为3类的38个,注册分类4类的37个和注册分类5.2类的1个;ATC分类主要包括:心血管系统、呼吸系统和消化道及代谢等;2023年1月获批化药仿制药ATC分类详见图7;1月获批化药仿制药信息情况见表4;
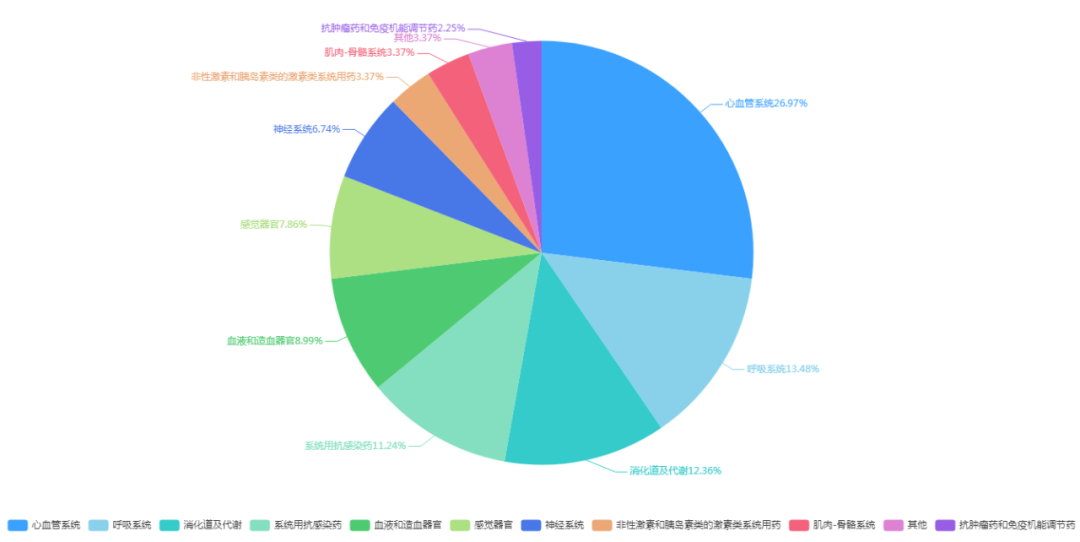
图7 2023年1月获批化药仿制药ATC分类(来源于药智数据)
图片来源:药智数据
表4 2023年1月获批化药仿制药信息
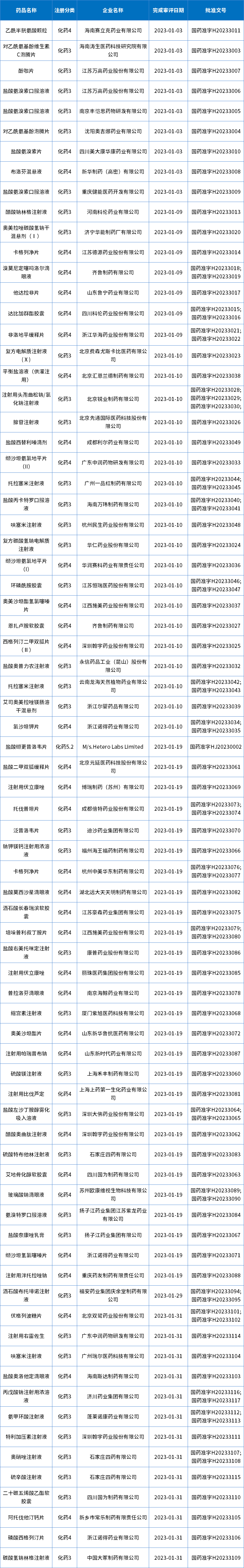
数据来源:药智数据,药智咨询整理
二、中药申报与审评情况
(一)中药受理情况
1月份CDE承办的中药注册申请受理号共计194个,其中新药8个,补充申请184个,仿制申请1个,一次性进口1个;2023年1月CDE中药各申请类型受理情况详见图8。

图8 2023年1月CDE中药各申请类型受理情况
数据来源:药智数据,药智咨询整理
1.中药新药申报情况
1月共承办5个中药1类创新药和2个2类改良型新药,共涉及7个品种,其中是IND申请5个,NDA申请2个;下表为1月新承办的中药新药。
表5 2023年1月新承办的中药新药
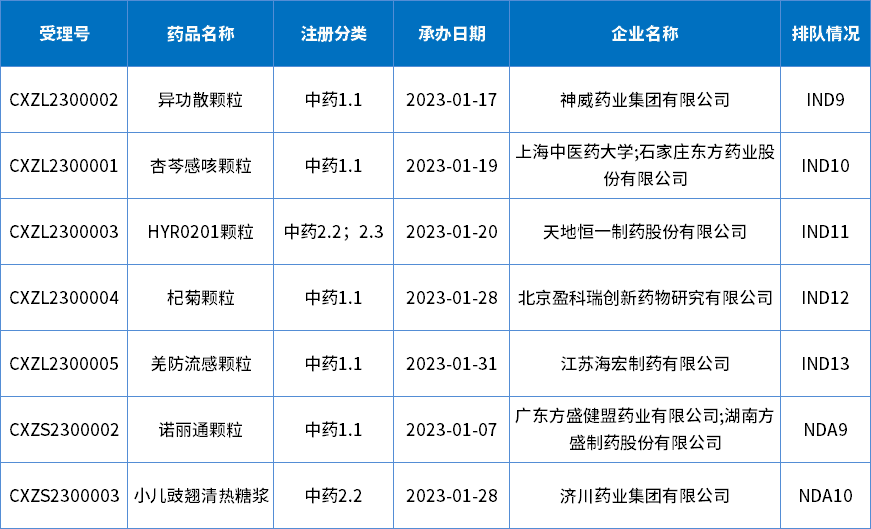
注:排队序号截止至2023年02月02日
数据来源:药智数据,药智咨询整理
(二)中药完成审评情况
1月份CDE完成审评的中药注册申请173个(以受理号计),其中新药受理号4个均为IND申请,补充申请168个,进口再注册1个;
在受理号审评结论方面,1月中药无新药获批,结论包括:批准补充165个,批准临床4个,未被批准3个。
三、生物制品审评情况
(一)生物制品受理情况
1月份CDE承办新的生物制品注册申请受理号共计184个,新药71个,补充申请65个,进口43个(其中包括一次性进口3个),进口再注册5个;2023年1月CDE生物制品各申请类型受理情况详见图9。

图9 2023年1月CDE生物制品各申请类型受理情况
数据来源:药智数据,药智咨询整理
1.生物制品1类新药申报情况
1月共66个生物制品1类新药受理号获得承办,其中,临床试验申请65个,上市申请1个,目前均已进入相应序列排队待审;下表为1月新承办的生物制品1类创新药。
表6 2023年1月新承办的生物制品1类新药
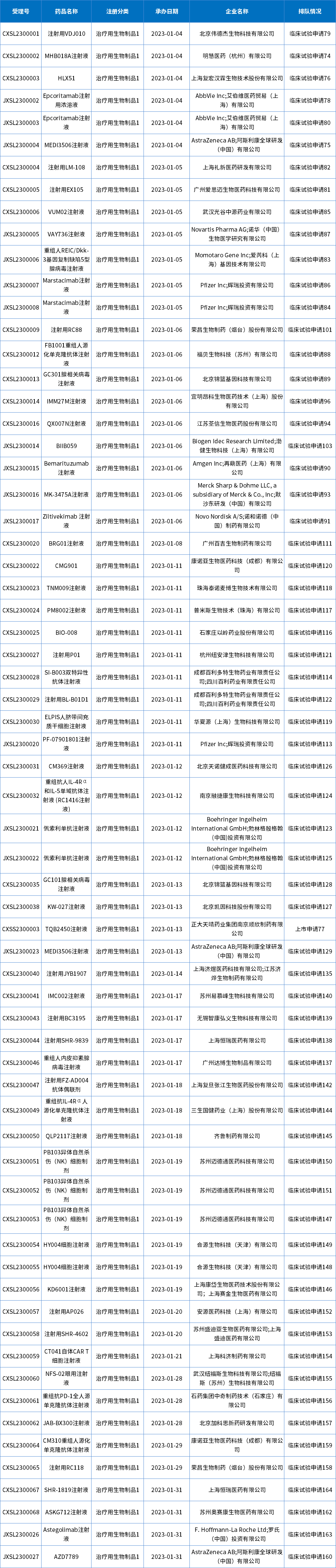
注:排队序号截止至2023年02月02日
数据来源:药智数据,药智咨询整理
(二)生物制品完成审评情况
1月份CDE完成审评的生物制品注册申请174个(以受理号计),其中新药申请受理号62个,进口受理号32个,补充申请71个,进口在注册9个;以审评任务类别统计(以受理号计),临床试验申请70个,上市申请20个,补充申请71个;2023年1月CDE生物制品各审评任务类别完成审评情况详见图10;
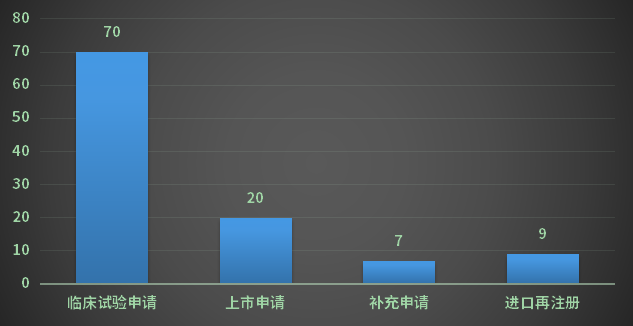
图10 2023年1月CDE生物制品各审评任务类别完成审评情况
数据来源:药智数据,药智咨询整理
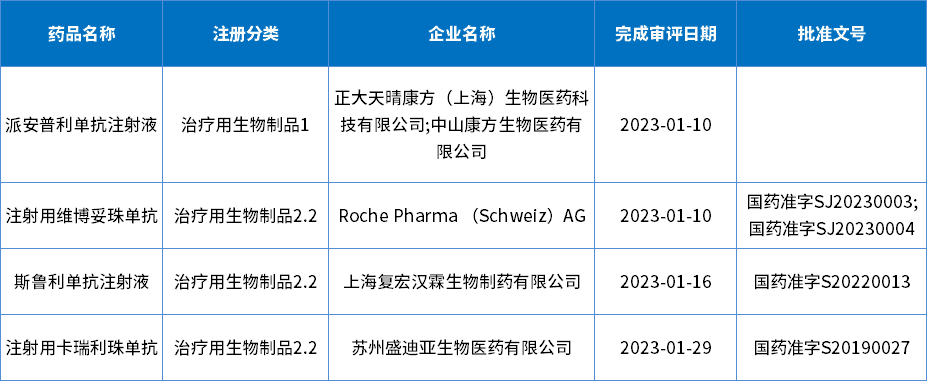
在受理号审评结论方面:批准临床107个,批准生产10个,批准进口10个,未被批准5个;其中1月份获批新药4个,包括1个1类新药和3个2类改良型新药;下表为1月生物制品批准上市新药信息。
表7 2023年1月生物制品获批新药信息
数据来源:药智数据,药智咨询整理
四、按一致性评价申报品种情况
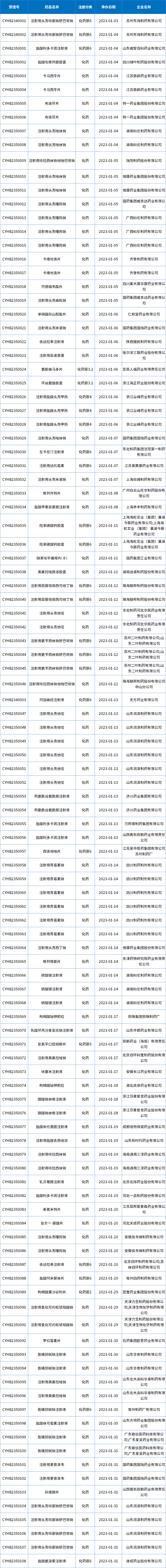
1月新增111个按一致性评价要求进行申报的受理号和289个视同受理号。(篇幅限制仅展示一致性信息,视同及具体信息请关注药智企业版药品注册与受理数据库);表8为1月新增一致性评价受理号信息。
表8 2023年1月新增一致性评价受理数据
数据来源:药智注册与受理数据库








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57