近日,海创药业股份有限公司(以下简称“公司”)收到国家药品监督管理局核准签发的《受理通知书》,PROTAC 药物 HP518 片拟用于治疗转移性去势抵抗性前列腺癌(mCRPC)的临床试验申请获得受理。
现将相关情况公告如下:
一、药品基本情况
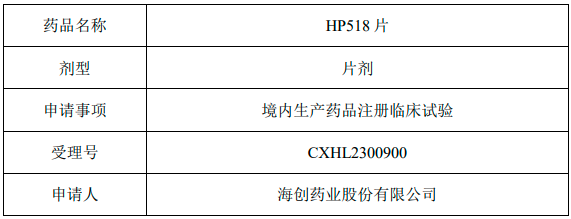
审批结论:根据《中华人民共和国行政许可法》第三十二条的规定,经审查,决定予以受理。
二、药品其他情况
HP518片是公司自主研发的雄激素受体 ( AR ) 的蛋白降解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC)药物,通过促进 AR 与 E3 连接酶结合,形成三元复合物,使得AR被泛素化,利用细胞内泛素蛋白酶体系统实现对AR 的降解,从而降低前列腺癌细胞中 AR 的蛋白表达水平,抑制依赖 AR 的前列腺癌细胞生长,达到治疗前列腺癌的目的。HP518 片临床拟用于治疗转移性去势抵抗性前列腺癌(mCRPC)。根据我国新化学药品注册分类规定,其药品注册分类为化药 1 类。
根据世界卫生组织数据,前列腺癌是常见的泌尿系统恶性肿瘤,位居全球男性癌症发病率的第二位和癌症死亡率的第五位,2020 年全球前列腺癌新发病例数达到 141万。近年来,中国前列腺癌的发病率呈现上升趋势。根据弗若斯特沙利文预测,到2024 年,中国前列腺癌新发病例数将达 14.4 万人,到 2030 年中国前列腺癌新发病例数达到 19.9 万人。预计到 2024 年中国新增前列腺癌 mCRPC 病例数将达到 16.0 万人,并于 2030 年达到 17.6 万人。
早期阶段的前列腺癌在经过去势治疗后,大多数患者会进展成mCRPC。目前mCRPC的治疗手段主要包括新型内分泌药物和化疗等。尽管这些治疗显著延长了患者的生存期,但 mCRPC 病人仍然会产生耐药。
HP518 已于 2021 年 10 月获准在澳大利亚开展临床 I 期试验,并于 2022 年 1 月实现首例患者入组,目前正在按计划推进中。HP518 在美国递交的剂量扩展 Ib 研究申请于 2023 年 1 月获得批准,目前正在进行临床试验准备工作。临床前研究显示 HP518 具有良好的有效性及安全性,且其具有高活性、高选择性,对野生型 AR 和恩扎卢胺耐药的变异 AR 具有高降解活性,对恩扎卢胺耐药的前列腺癌细胞系具有优异的抑癌活性。
因此,HP518 具有解决 mCRPC 患者经标准治疗失败产生耐药的潜力。
三、风险提示
由于医药产品具有高科技、高风险、高附加值的特点,药品的前期研发以及产品从研制、临床试验报批到投产的周期长、环节多,容易受到一些不确定性因素的影响,本次临床试验申请能否获得批准存在不确定性。敬请广大投资者谨慎决策,注意防范投资风险。
公司将积极推进上述研发项目,并严格按照有关规定及时对项目后续进展情况履行信息披露义务。有关公司信息请以公司指定披露媒体《中国证券报》《上海证券报》《证券时报》《证券日报》以及上海证券交易所网站刊登的公告为准。审批结论:根据《中华人民共和国行政许可法》第三十二条的规定,经审查,决定予以受理。
二、药品其他情况
HP518片是公司自主研发的雄激素受体( AR ) 的蛋白降解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC)药物,通过促进AR与E3连接酶结合,形成三元复合物,使得AR被泛素化,利用细胞内泛素蛋白酶体系统实现对AR 的降解,从而降低前列腺癌细胞中 AR 的蛋白表达水平,抑制依赖 AR 的前列腺癌细胞生长,达到治疗前列腺癌的目的。HP518 片临床拟用于治疗转移性去势抵抗性前列腺癌(mCRPC)。根据我国新化学药品注册分类规定,其药品注册分类为化药 1 类。
根据世界卫生组织数据,前列腺癌是常见的泌尿系统恶性肿瘤,位居全球男性癌症发病率的第二位和癌症死亡率的第五位,2020 年全球前列腺癌新发病例数达到 141万。近年来,中国前列腺癌的发病率呈现上升趋势。根据弗若斯特沙利文预测,到2024 年,中国前列腺癌新发病例数将达 14.4 万人,到 2030 年中国前列腺癌新发病例数达到 19.9 万人。预计到 2024 年中国新增前列腺癌 mCRPC 病例数将达到 16.0 万人,并于 2030 年达到 17.6 万人。
早期阶段的前列腺癌在经过去势治疗后,大多数患者会进展成mCRPC。目前mCRPC的治疗手段主要包括新型内分泌药物和化疗等。尽管这些治疗显著延长了患者的生存期,但 mCRPC 病人仍然会产生耐药。
HP518 已于 2021 年 10 月获准在澳大利亚开展临床 I 期试验,并于 2022 年 1 月实现首例患者入组,目前正在按计划推进中。HP518 在美国递交的剂量扩展 Ib 研究申请于 2023 年 1 月获得批准,目前正在进行临床试验准备工作。临床前研究显示 HP518 具有良好的有效性及安全性,且其具有高活性、高选择性,对野生型 AR 和恩扎卢胺耐药的变异 AR 具有高降解活性,对恩扎卢胺耐药的前列腺癌细胞系具有优异的抑癌活性。因此,HP518 具有解决 mCRPC 患者经标准治疗失败产生耐药的潜力。
三、风险提示
由于医药产品具有高科技、高风险、高附加值的特点,药品的前期研发以及产品从研制、临床试验报批到投产的周期长、环节多,容易受到一些不确定性因素的影响,本次临床试验申请能否获得批准存在不确定性。敬请广大投资者谨慎决策,注意防范投资风险。
公司将积极推进上述研发项目,并严格按照有关规定及时对项目后续进展情况履行信息披露义务。有关公司信息请以公司指定披露媒体《中国证券报》《上海证券报》《证券时报》《证券日报》以及上海证券交易所网站刊登的公告为准。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57