
2023年9月26日,国家药监局CDE官网发布“征求《药物临床试验不良事件相关性评价技术指导原则(征求意见稿)》意见的通知”(成文日期:2023年7月10日),征求截止日期:2023年10月26日。制定本指导原则的目的是在国内外相关研究基础上,进一步规范我国药物临床试验中不良事件与试验药物相关性评价方法与标准,为药物临床试验申办者、研究者、监管机构及其他相关人员开展药物临床试验中不良反应监测、识别、评估与控制相关工作提供借鉴与参考,以更好地践行临床试验风险最小化,保护受试者安全。本文为大家梳理了本指南中药物临床试验不良事件相关性评价有关条款内容并结合自己的解读与大家分享。
一、申办者为何需构建药物临床试验安全信息监测评估体系?
我国自2018年加入ICH以来,全面实施ICH E2A《临床安全性数据管理:快速报告的定义和标准》(Clinical Safety Data Management:Definitions and Standards for Expedited Reporting)和相关技术要求;同时,2019年新版《药品管理法》、2020年新版《药品注册管理办法》以及2021年发布的我国第一部《药物警戒质量管理规范》中,都对于药物临床试验期间安全风险监测、评估、分析、控制提出了更加明确的要求,明确了申办者的主体责任,临床试验期间持续完善药物临床试验安全性研究、临床试验期间安全风险监测评估分析与控制,切实实施临床试验风险最小化,保护好受试者安全。
当前迫切需要进一步规范我国临床试验不良事件与试验药物相关性的评价方法和标准,因为对于一些申办方属于,中小企业或初创公司,尚缺乏风险评估相关经验与完善的技术体系,WHO及我国上市后相关性评价标准和方法并不完全适用于上市前/临床试验期间,对其不合理地使用会导致临床试验安全风险评估不科学、不规范,申办者无法及时发现和控制安全风险,最终造成对临床试验受试者安全和健康的危害。
二、临床试验不良事件与试验药物相关性的评价方法和标准有哪些新亮点?
1、明确了制定目的、技术范围、适用对象
药物临床试验不良事件相关性评价技术指导原则在国内为首次制定,国外也无相应的指南/指导原则可资参考,新规明确了制定目的、技术范围、适用对象,见下表:

2、明确药物临床试验不良事件相关性评价中需要考虑的各种因素
准确评价临床试验不良事件与试验药物的相关性,可能受到多方面因素的影响和制约,常见的考虑因素包括以下几个方面:
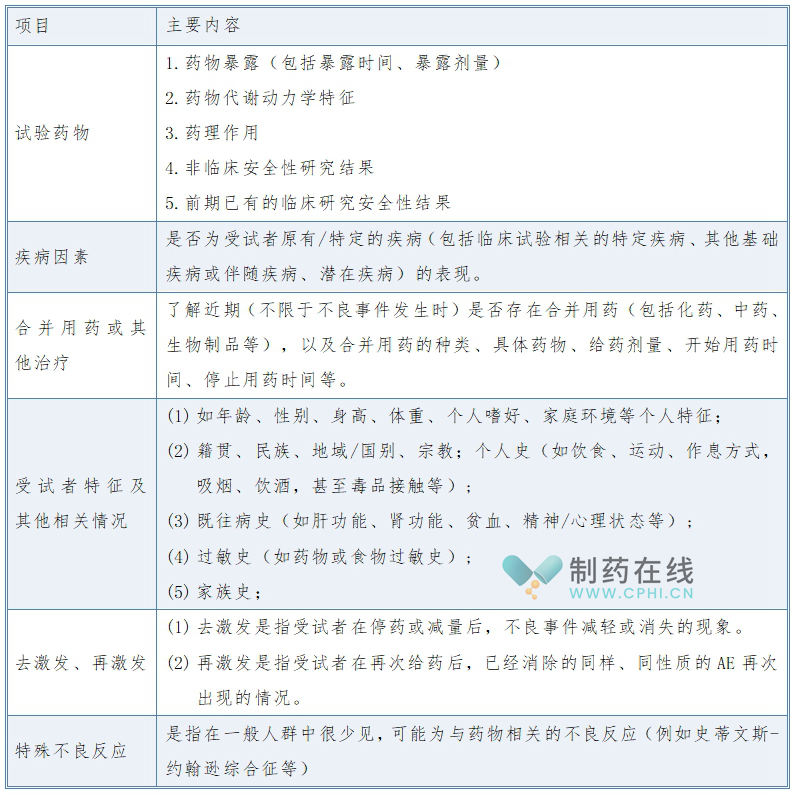
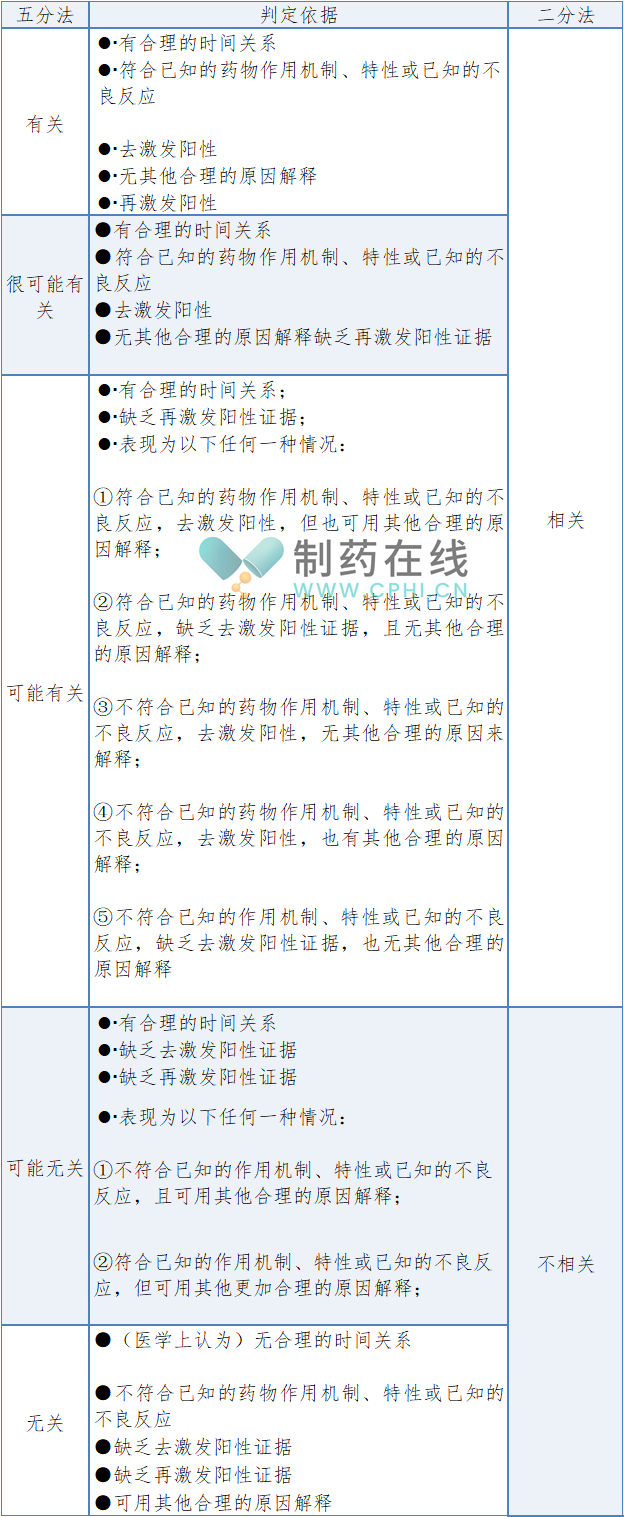
3、制定药物临床试验不良事件相关性评价的分类方法和判定依据
起草组专家综合各种因素考虑及讨论结果,《药物临床试验不良事件相关性评价技术指导原则(征求意见稿)》推荐目前药物临床试验中不良事件相关性评价采用五分法;同时,考虑到部分临床试验的国际性需求及现状,也允许采用二分法;从SUSAR快速报告工作等方面考虑,指导原则中也明确了二分法和五分法在技术上的对应关系。若申请人采用其他的分类方法和判定标准,指导原则中明确“应在临床试验方案中说明其科学合理性依据”。判定结果分类及判定依据参见下表:
参考文献
[1] www.nmpa.gov.cn、www.cde.org.cn/等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57