https://www.cphi.cn 2024-04-30 14:07 来源:CPHI制药在线 作者:滴水司南
临床研究作为落实国家科技创新战略的核心环节,对于提升临床诊疗技术和保障人民健康水平具有至关重要的作用。近日,全国团体信息平台公布了由中国医药生物技术协会主导制定的《临床研究中心建设与管理规范》团体标准征求意见稿,这被视为中国版的"临床研究中心建设与管理指南"。该规范详尽地阐述了临床研究中心的功能定位、组织架构、管理制度、人员配置、基础设施以及评估机制等关键要素,为医疗卫生机构内的临床研究中心建设与管理提供了明确的指导。该规范的发布填补了国内在临床研究中心建设与管理方面的空白,不仅有助于提升我国临床研究的质量和水平,也将为推动我国医药行业的健康发展注入强大动力。
一、国内临床研究体系规范化建设的必要性
国内临床研究体系规范化建设的必要性在于,当前临床研究体系尚不完善,管理体系、组织架构等方面存在诸多不足,严重制约了研究开展与成果转化。缺乏统一的研究规范和标准,导致研究质量参差不齐;临床研究中心建设缺乏专业、全面的顶层设计,影响了研究效率与效果;临床研究人员准入制度与专业度标准不一,技术支撑不足,制约了研究水平的提升。此外,国内临床研究还面临研究数量及转化不足、高质量研究数据缺乏等困境。因此,制定全面指导性文件以规范和指导临床研究体系规范化建设至关重要。通过规范临床研究管理体系、架构和制度,建立专业的临床研究中心实体机构,提升临床研究质量和效率,推动国内临床研究的发展,为提升我国医学水平和国际竞争力提供有力支撑。
二、《临床研究中心建设与管理规范》标准信息
|
项目 |
内容 |
|
中文名称 |
《临床研究中心建设与管理规范》 |
|
英文标题 |
Construction and management specification for developing clinical research unit |
|
发布日期 |
2024年04月16日公示稿 |
|
起草单位 |
中国医药生物技术协会临床研究专业委员会、上海申康医院发展中心、上海交通大学医学院、中国医科大学附属第一医院、山东大学齐鲁医院、四川大学华西医院、北京大学、上海市第一人民医院、上海交通大学医学院附属儿童医院、复旦大学附属儿科医院、上海市第一妇婴保健院。 |
|
起草人 |
钱碧云、张维拓、吕明、吉萍、周宝森、陈蕾、吕文文、钱颖、谢丽、丁雪鹰、邹琳、施鹏、李珍。 |
|
主要技术内容 |
本文件规定了临床研究中心的功能、组织架构、管理制度、人员配置、基础设施和评估等要求。 |
三、临床研究中心建设与管理监管合规的关注点
国内尚未出台针对临床研究中心建设与管理规范的规定,且目前也无相关法规对行业进行更具体的指导,如何合法、合规一直是业界高度关注的,本文结合《临床研究中心建设与管理规范》,梳理了临床研究中心建设与管理规范监管合规的关注点,如有遗漏,欢迎大家留言补充,主要技术内容和适用范围如下:
(1) 主要技术内容:该指南分为九大章和一个附录,主要包括范围、规范性引用文件、术语和定义、功能、组织架构、人员配置、基础设施、管理制度、评估、附录和文献等。
(2) 适用范围:本文件适用于医疗卫生机构内设的临床研究中心建设与管理。
(3) 标准购买信息:目前该团体标准公示稿文本需要查看原文可到全国团体信息平台https://www.ttbz.org.cn/Home/Show/74003。
(4) 临床研究中心建设与管理有哪些主要关注点?
(一)组织架构搭建
一般情况下,临床研究中心(简称CRU)应在临床研究管理委员会和临床研究学术委员会指导下工作,设办公室、技术支持、临床研究管理和平台统筹等部门,并建立相关岗位职责,CRU组织架构(示意图)见下图:
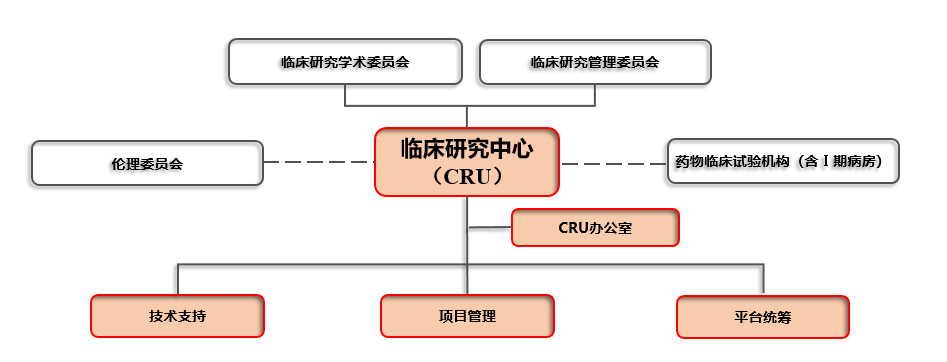
(二)人员配置
CRU应设立中心主任,负责统筹协调各项事务。同时,可设执行主任/副主任,需具备临床研究经验和科研管理能力。机构内还应配备方法学人员、数据管理人员,分别负责临床研究方案设计、统计分析以及数据管理核查等工作。此外,还需根据项目规模配备项目管理/质量管理人员,确保临床研究规范化管理与质量保障。临床科室应配备临床研究高级助理、研究护士等,协助推进研究计划。机构还应有项目开发、成果转化、教育培训等人员。所有人员均需持有GCP培训证书,并接受临床研究方法学培训。
(三)基础设施配置--研究型病房、专病数据库与生物样本库
CRU应建立CRW(临床研究病房)并建立相关使用规范,提供方法学支持,并划分为筛选、医疗、操作和办公区,各区功能明确。同时,CRU应配备必要医疗与科研设备,建立数字化信息平台,并配备专职管理和技术人员。此外,CRU还需建立支撑保障体系与运行管理制度。
CRU应建立专病数据库与生物样本库建设并建立相关使用规范,包括参与数据库建设、提供技术支撑、组织设立专家委员会、协助构建数据集标准,并推动数据库与样本库的对接整合与规范使用。
(四)软件系统配置--临床研究信息系统
临床研究信息系统是CRU的核心支撑。它需配备高性能的硬件平台,包括计算、存储、网络和安全设备,确保数据的安全可靠。同时,系统应包含项目管理、数据管理和统计软件等基础软件,实现临床研究项目的统一规范化管理,并提供EDC、随机化系统等功能。此外,CRU还应根据所在机构的需求,为专病库、生物样本库等建设相应功能模块。系统应符合相关标准,实现与医疗卫生机构内部数据平台及其他业务系统的互通兼容。同时,必须遵循国家网络安全等级保护制度,并具备对信息系统的规范化运营管理和日常维护能力。
(五)软件系统配置--管理制度
临床研究中心(CRU)在支撑和推进临床研究工作中,需建立一套完整而严谨的管理制度,以确保研究过程的规范性、数据的准确性和研究结果的可靠性。这些管理制度包括文件管理制度、临床研究项目管理制度、临床研究数据管理制度、临床研究质量管理制度、临床研究项目经费管理制度、临床研究项目文档管理制度以及临床研究方法学的相关制度与标准操作程序(SOP)等。CRU应建立管理制度清单(示例)如下表:
|
管理制度名称 |
管理制度主要内容(示例) |
|
文件管理制度 |
SOP的命名规则、制定、修改、批准、发布流程,临床研究参与人员的培训、记录与考核。 |
|
临床研究项目管理制度 |
立项申请与审批、项目启动、中期考核、结题验收,保证临床研究项目管理的全生命周期规范化开展。 |
|
临床研究数据管理制度 |
CRF表设计、数据库搭建、数据采集、数据质量控制、数据安全和监察、数据库锁定,保证临床研究数据质量和数据安全。 |
|
临床研究质量管理制度 |
三级质量管理体系、项目监查、项目稽查,保证临床研究数据的真实、完整、准确和受试者安全与权益。 |
|
临床研究项目经费管理制度 |
经费预算审批、启动、采购、报销、审计,保证项目经费规范使用。 |
|
临床研究项目文档管理制度 |
临床研究工作文件标准模板、工作文件资料归档与保存的规范。 |
|
临床研究方法学的相关制度与SOP |
研究咨询、研究方案修改、统计分析、论文中方法学部分撰写,为研究者提供标准化的方法学支持。 |
|
人员培训、考核与激励制度 |
各类角色工作人员的工作职责、培训计划与考核方式。 |
参考文献
[1] www.ttbz.org.cn、中国医药生物技术协会网页等
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030