黑色素相关抗原A4(MAGE-A4)是一种肿瘤/睾丸组织中抗原,属于MAGE-As蛋白家族亚型。MAGE-As是一种肿瘤特异性抗原,家族成员包括MAGE-A1、MAGE-A2……等15个成员,研究发现人类许多其它组织来源的肿瘤都至少表达一种MAGE-A基因。MAGE-A在细胞内可被加工成抗原肽,与HLA-I类分子相结合形成复合物,通过MHC I类分子提呈给CD8+T细胞,在肿瘤患者体内诱发肿瘤特异性免疫应答。
关于MAGE-A4
MAGE-A4是MAGE-A亚家族的重要成员,具有很好的组织学特异性,广泛表达于滑膜肉瘤 (SS)、粘液样/圆形细胞脂肪肉瘤 (MRCLS)、非小细胞肺癌 (NSCLC)、头颈部鳞状细胞癌 (HNSCC) 以及卵巢癌、尿路上皮癌、黑色素瘤和胃食管癌等多种实体瘤组织,但在正常组织(睾丸、胎盘除外)中低表达。
MAGE-A4与肿瘤的发生、发展、转移及预后密切相关。研究发现,MAGE-A4与抑癌基因P53(p53可促使癌细胞凋亡并控制细胞周期)呈正相关,其C端107个氨基酸片段通过与Miz-1部分结合可诱导P53-依赖和P53-非依赖的独立机制,增强P53的转录活性,减少p21(Cip1)转录子和蛋白水平。
而且,研究发现MAGE-A4还可活化跨损伤DNA合成(TLS)途径的活化,抑制对正常细胞的损伤修复,选择性活化化疗细胞DNA损伤修复,造成肿瘤细胞损伤的修复,从而引起肿瘤细胞对化疗药的耐药。
MAGE-A4靶向药进展
MAGE-A4被认为是肿瘤治疗的潜力靶点,目前全球药企针对该靶点已开发出几款在研药物,详见下表。其中Adaptimmune Therapeutics的Afamitresgene Autoleucel (Afami-cel)进展最快,其治疗晚期滑膜肉瘤的BLA正在美国接受优先审查,PDUFA日期为2024年8月4日。
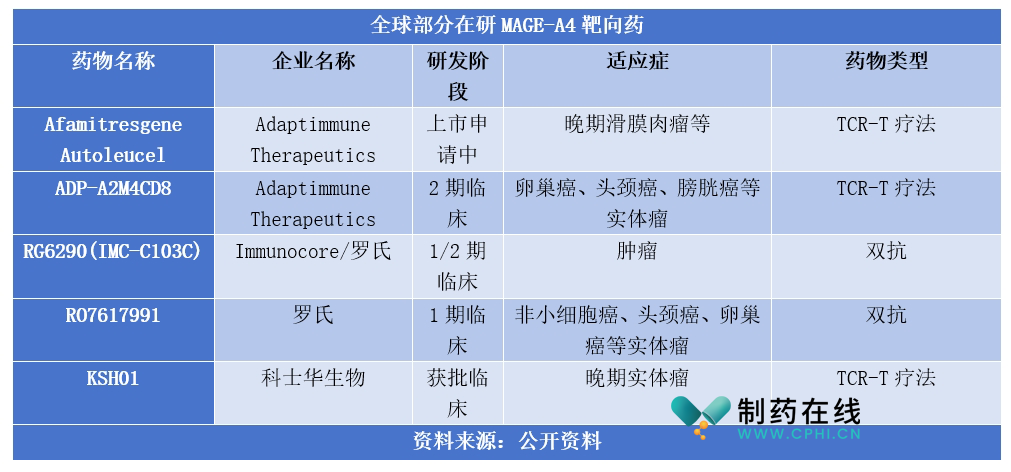
资料来源:公开资料
Adaptimmune Therapeutics领跑,Afami-cel即将出线
Afami-cel是一款针对MAGE-A4癌症抗原的TCR-T疗法,其从患者体内提取T细胞并使用慢病毒载体进行基因工程改造,表达靶向HLA-A*02呈递的MAGE-A4 230-239 GVYDGREHTV的高亲和力和特异性T细胞受体(TCR),该TCR引导T细胞靶向表达MAGE-A4的癌细胞并清除这些癌细胞。
滑膜肉瘤和粘液样/圆形细胞脂肪肉瘤(MRCLS)是两种极其罕见的恶性肿瘤,占所有软组织肉瘤的5%-10%,常规治疗后一旦发生复发转移,预后极差,临床上迫切需要有效的治疗方案。已公布的Afami-cel在晚期滑膜肉瘤或粘液样/圆形细胞脂肪肉瘤患者中开展的关键2期临床试验SPEARHEAD-1队列1数据显示:截至2022年8月29日,共52例(44例滑膜肉瘤,8例MRCLS)患者接受Afami-cel治疗,客观缓解率(ORR)为36.5%,疾病控制率(DCR)为88.4%。中位随访27.8个月时,中位持续反应时间(DOR)为11.6个月。
其中,Afami-cel在经过大量预先治疗的晚期滑膜肉瘤患者中的ORR为39%,中位生存期约为17个月。而且,接受Afami-cel治疗有缓解的晚期滑膜肉瘤患者中,70%的人在治疗两年后仍然存活。
安全性方面,与先前的研究结果一致,Afami-cel安全性可接受,最常见的副作用包括红细胞和白细胞计数低。
值得一提的是,若顺利,Afami-cel或成为首 个获批治疗实体瘤的TCR-T细胞疗法,也是十多年来首 个获批治疗滑膜肉瘤的新疗法。
此外,Adaptimmune Therapeutics还开了另外一款MAGE-A4靶向TCR-T细胞疗法ADP-A2M4CD8。该疗法经CD8α辅助受体修饰,用于治疗符合条件的患有不可切除/转移性实体瘤的人类白细胞抗原A*02患者。已公布的1期临床试验SURPASS结果显示:ADP-A2M4CD8单一疗法在晚期/转移性实体瘤患者中表现出可接受的获益风险比,以及令人鼓舞的抗肿瘤活性。因抑制免疫抑制途径可能会改善抗肿瘤反应,因此新的SURPASS队列包括ADP-A2M4CD8联合纳武利尤单抗或帕博利珠单抗。
罗氏进军MAGE-A4靶点,但进展不顺
IMC-C103C是基于Immunocore公司专有的ImmTAC®技术平台开发的一种新型双特异性蛋白,由亲和增强的TCR和一种靶向CD3的抗体片段组成,一端可以识别MAGE-A4,另一端可以激活T细胞表面的CD3受体,从而使T细胞重新定位以杀伤表达MAGE-A4的肿瘤细胞。
已公布的IMC-C103C治疗卵巢癌的1期临床试验扩展数据显示:在17例可评估的MAGE-A4阳性患者中,1例患者获得持久的PR,持续时间为12.7个月,6例患者为SD,其中1例在数据截止后转变为未确认的PR。而且,在超过一半(12/22)的ctDNA可评估的患者中观察到ctDNA水平的降低,其中7例降低≥50%。
2018年11月,罗氏与Immunocore签署新的研发合作协议,共同开发IMC-C103C(RG6290)。遗憾的是,RG6290于2023年从罗氏的研发管线中剔除。
不过,罗氏并没有放弃在MAGE-A4靶点布局,在推进RG6290的过程中开发了RG6129。RG6129是一款治疗实体肿瘤的双特异性抗体,靶向HLA-A2-MAGE-A4和CD3。该疗法的临床试验在2021年启动后,并未公布任何结果,随后在2023年被终止。
此外,目前罗氏手里还有一款MAGE-A4/CD3 TCR双抗药物RO7617991。今年4月,罗氏在clinical trails网站上,登记了一项RO7617991在MAGE-A4阳性(HLA)-A*02型患者中开展1期临床试验NCT06372574,计划总入组人数为210例。
我国药企布局MAGE-A4靶点,KSH01获批临床
我国药企科士华也积极布局MAGE-A4靶点,其开发的KSH01是我国首 个靶向MAGE-A4抗原的TCR-T疗法。KSH01的核心序列是依托科士华生物的核心技术平台TCR-XFinder™及TCR-XPlanet™ T细胞数据库,从患者体内快速筛选出的具有强效抗肿瘤活性的天然来源TCR序列。
KSH01也是我国首 个针对消化道和泌尿系大癌种的TCR-T疗法,2023年3月被FDA授予孤儿药资格。今年4月该疗法在国内获批临床,治疗晚期实体瘤。
总结
作为肿瘤药研发的潜力靶点,MAGE-A4靶点布局企业相对较少,而且进展并不顺利,罗氏的两款药物先后终止。Adaptimmune Therapeutics是MAGE-A4领域的领头羊,其开发的Afami-cel针对滑膜肉瘤的BLA正在美国接受优先审查。我国药企科士华在MAGE-A4领域也有布局,但相关产品进展较慢,近期才在国内获批临床。整体来看,MAGE-A4靶点还处于早期阶段,未来前景还充满不确定性,企业在布局的时候切忌盲目跟进。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57