
这两项研究表明,长久以来流行的抗CTLA-4抗体Ipilimumab在癌症免疫治疗中的免疫检查点假说并不成立,即Ipilimumab并没有通过阻断CTLA-4/B7相互作用而发挥抗肿瘤效果,而清除Fc受体介导的高表达CTLA-4的肿瘤局部调节性T细胞(Treg)则在有效的免疫治疗中至关重要。作者利用CTLA-4人源化的新生小鼠模型,模拟临床上Ipilimumab单用以及联用造成的各个脏器的免疫副作用,并评估了其它抗CTLA-4抗体的安全性,阐明了失调的自身反应性Treg及全身T细胞的活化是造成免疫副作用的根本原因。这些研究成果对今后研发新一代高效并且安全的抗CTLA-4抗体以及其它以CTLA-4为靶点的药物有着深远的指导意义。
近年来,随着肿瘤免疫调控机制的逐渐清晰和基因改造技术的不断提高,肿瘤免疫治疗领域得到了空前发展。尤其是近几年来,免疫检查点 (Immune Checkpoint)单抗药物与嵌合抗原受体T(CAR-T)细胞免疫治疗的效果逐渐获得认可,癌症免疫治疗的概念也越来越深入人心。目前肿瘤免疫药物治疗的最主要方面是肿瘤免疫检查点抑制剂,即通过抑制肿瘤细胞的免疫逃逸,调动自身免疫系统功能来消除肿瘤,当前的研究主要集中在CTLA-4、PD-1和PD-L1三个分子上。
CTLA-4分子高表达于调节性T淋巴细胞(Treg)和激活的T淋巴细胞上。正常情况下,T淋巴细胞的活化需要两条信号通路共同激活,其一是T细胞受体(TCR)与抗原呈递细胞(APC)呈递的MHC-抗原肽复合物相结合(信号1),其二是B7分子(B7-1或B7-2)与T细胞表面的共刺激分子CD28相结合(信号2)。T细胞活化后高表达的CTLA-4分子虽然与CD28具有高度同源性,但功能相反,即CTLA-4分子与B7分子结合后抑制T细胞的活化。
2011年,美国FDA批准首款抗CTLA-4抗体抑制剂Ipilimumab(商品名YERVOY?)用于黑色素瘤的治疗,疗效显著。根据免疫检查点阻断的假说(Checkpoint Blockade Hypothesis),在外周淋巴器官,抗CTLA-4抗体如Ipilimumab是主要通过阻断抑制性的CTLA-4/B7信号通路【图1】,从而促进T细胞的激活而发挥抗肿瘤作用。然而这一流行的关于Ipilimumab在癌症免疫治疗中发挥作用的主要假说并没有得到严格的实验验证。
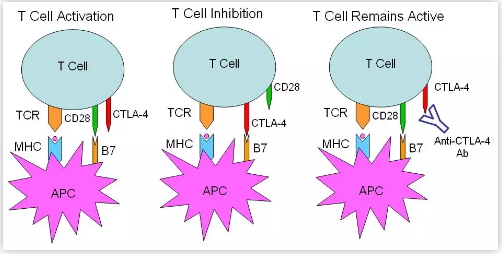
图1. T细胞的活化需要通过TCR/MHC(信号1)和CD28/B7(信号2)进行共刺激。 抗原呈递细胞(APC)上的B7分子(包括B7-1和B7-2)与T细胞上的CTLA-4的结合抑制T细胞功能。 抗CTLA-4抗体阻断CTLA-4结合B7并阻止其对T细胞功能的抑制。
虽然Ipilimumab可以阻断锚定状态的(Immobilized )CTLA-4分子和游离的(Soluble )B7分子的相互作用【图2A】(J Immunol. 2003 Dec 1;171(11):6251-9.),但B7分子是膜表面表达的共刺激分子,因此以前的研究并不能证实Ipilimumab能够有效阻断在生理状态下的CTLA-4和B7的相互作用。刘阳/郑盼教授联合实验室的研究表明,当B7分子被固定后(比如B7包被在ELISA板上时【图2B】或者表达在细胞表面【图2C】),Ipilimumab(包括临床上使用的Ipilimumab以及按照已公布的抗体序列由不同公司合成的Ipilimumab)在体外并不能很好地阻断细胞表面的CTLA-4/B7的相互作用【图2D】,也不能有效地阻断CTLA-4介导的B7分子的转胞吞(Transendocytosis)作用【图2E】。与此不同的是,刘阳/郑盼教授联合实验室筛选出的另外一种抗CTLA-4的半人源化的抗体L3D10 (Blood. 2005 Feb 1;105(3):1114-20.和Blood. 2005 Nov 1;106(9):3127-33.),却能非常显著地阻断各种形式的CTLA-4/B7的体外相互作用【图2】。 此外,在human CTLA-4 knock-in的人源化小鼠和human CD34+ stem cells重组的NSG小鼠中,L3D10——而不是Ipilimumab——能够显著抑制human CTLA-4对脾 脏树突状细胞表面B7分子的转胞吞下调【图2F】,从而提供了在体内实验中的生理状态下Ipilimumab不能有效阻断CTLA-4/B7相互作用的证据。
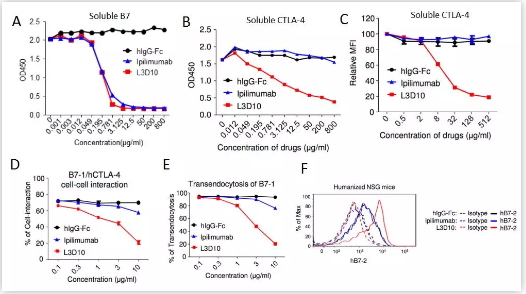
图2. 当B7分子被固定时,L3D10——而不是Ipilimumab——能够在体外和体内显著阻断CTLA-4/B7的相互作用。(摘自Cell Research (2018) doi:10.1038/s41422-018-0011-0)
更重要的是,刘阳/郑盼教授联合实验室的研究指出,阻断CTLA-4/B7的相互作用,并没有贡献于抗CTLA-4抗体的抗肿瘤效果。这一论断来自多个方面的实验证据:
1)在human CTLA-4全人源化(CTLA4h/h,即CTLA4的两个等位基因均来自human)的小鼠模型中,抗human CTLA-4的抗体L3D10能够有效阻断CTLA-4/B7的相互作用;而在human CTLA-4半人源化(CTLA4h/m,即CTLA4的两个等位基因一个来自human,一个来自mouse)的小鼠模型中,只能识别human CTLA-4的L3D10不能有效阻断CTLA-4/B7的相互作用。尽管如此,在CTLA-4全人源化和半人源化的小鼠模型中,L3D10和Ipilimumab都能有效的消除MC38肿瘤【图3A、图3B】和减缓B16肿瘤的生长。
2)将半人源化的L3D10进行完全人源化后筛选得到的两株失去阻断CTLA-4/B7相互作用能力的HL12和HL32抗体【图3C】,并没有影响其抗肿瘤的作用,因为HL12和HL32展现出与Ipilimumab一样的抗肿瘤效果【图3D】。
3)用B7分子的阻断性抗体1G10/GL1处理实验小鼠,在事先阻断B7功能的情况下,Ipilimumab仍能发挥有效的抗肿瘤作用,进一步说明其并不依赖于阻断抑制性的CTLA-4/B7信号通路【图3E】。
4)三种常见的抗mouse CTLA-4抗体(4F10/9D9/9H10),它们阻断CTLA-4/B7相互作用的能力差别很大(如9D9和L3D10一样具强阻断能力,而9H10则不显示或者具备非常弱的阻断能力)。然而,文献报道它们都具备非常好的抗肿瘤作用。
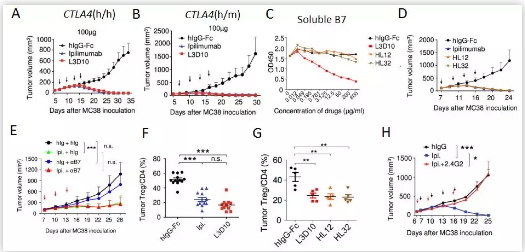
图3. 抗CTLA-4抗体治疗肿瘤的主要分子机制是通过清除肿瘤局部的Treg,而不是通过阻断CTLA-4/B7相互作用的抑制性信号通路。(摘自Cell Research (2018) doi:10.1038/s41422-018-0011-0)
深入研究表明,所有能有效抗肿瘤的抗CTLA-4抗体,包括强阻断能力的L3D10和非常弱阻断能力的Ipilimumab/HL12/HL32,都能够有效的清除肿瘤局部的Treg【图3F,图3G】。而用Fc受体的阻断抗体2.4G2同时处理小鼠来消除抗体介导的细胞杀伤作用(antibody-dependent cellular cytotoxicity, ADCC)和抗体介导的细胞吞噬作用(antibody-dependent cellular phagocytosis,ADCP),则能显著逆转Ipilimumab的抗肿瘤效果【图3H】。因此,刘阳/郑盼教授联合实验室的研究表明,抗CTLA-4抗体发挥治疗肿瘤功效的主要分子机制是通过清除肿瘤局部的Treg,而不是通过阻断CTLA-4/B7相互作用的抑制性信号通路。这项研究有力地驳斥了当前流行的在癌症免疫治疗中针对CTLA-4分子的免疫检查点的理论假说。
刘阳/郑盼教授联合实验室在CTLA-4领域的另一个方面的研究,集中在建立和评估抗CTLA-4抗体在免疫治疗诱导的副作用(irAE,immunotherapy related adverse events)的小鼠模型。Ipilimumab作为肿瘤免疫治疗的杰出代表,具有非常好的抗黑色素瘤的作用,同时也有非常强的免疫治疗诱导的副作用(N Engl J Med. 2015 Jul 2;373(1):23-34.)。临床研究表明,针对多靶点的更有效的联合用药是免疫治疗的临床推进方向,例如Ipilimumab和Nivolumab (抗PD-1的抗体)强强联合后抗肿瘤效果大增。然而,一半以上的患者产生了3-4级严重的副作用,因此限制了抗CTLA-4抗体的研发与应用(Lancet Oncol. 2017 Jan;18(1):31-41.和N Engl J Med. 2017 Nov 9;377(19):1824-1835.)。 目前,并没有一个非常好的临床前模型来评估抗CTLA-4抗体的免疫治疗诱导的副作用。

图4. 利用CTLA-4人源化的新生小鼠模型来模拟临床上Ipilimumab单用以及联用造成的免疫副作用,并评估Ipilimumab和其它抗CTLA-4抗体的安全性。(摘自Cell Research (2018)doi:10.1038/s41422-018-0012-z)
研究发现, CTLA-4人源化的新生小鼠模型【图4A】,可以用来有效地模拟临床上Ipilimumab单用以及联用造成的各个脏器的免疫副作用。这些副作用的表型和临床发现的Ipilimumab单独治疗或联合抗PD-1抗体治疗后产生的副作用表型非常相似【图4B】。比如,贫血,心肌炎,肺炎,肝炎,肾 脏等多器官炎症。值得注意的是,半人源化抗体L3D10以及其完全人源化后的突变体抗体HL12和HL32在取得与Ipilimumab一样的甚至强于Ipilimumab的抗肿瘤效果的情况下,并没有产生严重的副作用【图4C】。同样,利用human CTLA-4全人源化(CTLA4h/h )和半人源化(CTLA4h/m)的新生小鼠模型,研究者发现,再现Ipilimumab的免疫副作用需要CTLA4双等位基因的参与,因为在半人源化新生小鼠模型中, Ipilimumab并没有显示出强烈的副作用【图4D】。
此外,研究者还发现这种免疫治疗诱导的副作用,和全身的T细胞激活相关,特别是自我反应性T细胞中调节性T细胞(Treg)和效应T细胞(Teff)的比例起决定性的作用。这项研究表明,抗CTLA-4抗体的抗肿瘤效果和免疫治疗副作用的产生并不一定是相伴相随的,因为它们的分子机制是不一样的(一个依赖于肿瘤局部Treg的删除,一个依赖于自体反应性T细胞的扩增和全身T细胞的激活, 【图5】)。

图5. 抗CTLA-4抗体在免疫治疗诱导的副作用(irAE,immunotherapy related adverse events )和 癌症免疫治疗效果(CITE,cancer immunotherapeutic effect)中有着截然不同的分子机制。 irAE是外周淋巴器官中自体反应性T细胞的多克隆扩增造成的,主要是通过抑制自身反应性T细胞转化成自身反应性Treg细胞。 CITE引起的肿瘤排斥是通过FcR介导的特异性清除肿瘤微环境中的Treg细胞来实现的,并且此过程独立于外周淋巴器官中天然T细胞的活化。此外,irAE和CITE都不依赖于对CTLA-4/B7相互作用的阻断。(摘自Cell Research (2018)doi:10.1038/s41422-018-0012-z)
刘阳/郑盼教授联合实验室的一系列突破性研究成果,进一步阐明了抗CTLA-4抗体的抗肿瘤分子机制,提供了有效的评价抗CTLA-4抗体药物安全性的小鼠模型,并初步筛选到相对于Ipilimumab更加安全的抗CTLA-4抗体克隆株HL12和HL32,这些研究对今后第3代抗CTLA-4抗体以及以CTLA-4为靶点的其它类型药物的研发有着重要的指导意义。
据悉,本研究完成于美国国立儿童医学中心的癌症与免疫学研究中心。杜雪相博士、唐飞博士和刘明月博士为两篇论文的共同第一作者,刘阳教授和郑盼教授为共同通讯作者。
参考文献:
Keler, T. et al. Activity and safety of CTLA-4 blockade combined with vaccines in cynomolgus macaques. J. Immunol. 171, 6251–6259 (2003).
Lute K. D., et al. Human CTLA-4-knock-in mice unravel the quantitative link between tumor immunity and autoimmunity induced by anti-CTLA-4 antibodies. Blood 106, 3127–3133 (2005).
May, K. F., et al. Anti-human CTLA-4 monoclonal antibody promotes T cell expansion and immunity in a hu-PBL-SCID model: a new method for preclinical screening of costimulatory monoclonal antibodies. Blood 105, 1114–1120 (2005).
Larkin, J., et al. Combined Nivolumab and Ipilimumab or monotherapy in untreated melanoma. N. Engl. J. Med. 373, 23–34 (2015).
Hellmann, M. D., et al. Nivolumab plus Ipilimumab as first-line treatment for advanced non-small-cell lung cancer (CheckMate 012): results of an open-label, phase 1, multicohort study. Lancet Oncol. 18, 31–41 (2017).
Weber, J., et al. Adjuvant Nivolumab versus Ipilimumab in resected stage III or IV melanoma. N. Engl. J. Med. 377, 1824–1835(2017).



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57