2020年11月4日,国家药品监督管理局药品审评中心官网发布《中药新药研究各阶段药学研究技术指导原则(试行)》,自发布之日2020年11月4日起实施,此指南为鼓励中药传承创新发展,落实《药品管理法》、《中医药法》、《中共中央、国务院关于促进中医药传承创新发展的意见》等文件**,遵循中药新药研发规律,提高中药新药研发的质量和效率,引导申请人合理开展中药新药研,该指导原则的正式实施将填补国内中药新药研发药学研究的一大空白,助力国内中药质量的进一步提升,本文为大家梳理了本指导原则中关于中药新药全生命周期研究中不同阶段药学研究重点内容并结合自己的解读与大家分享。如有不妥,恳请大家提出宝贵意见。
一、中药新药药学研究难点
中药新药研究是一项涉及药学、药理毒理、临床等多学科研究的系统工程,药学研究主要包括处方药味及其质量、剂型、生产工艺、质量研究及质量标准、稳定性等研究内容。中药新药研究应在中医药理论指导下,根据中药特点、新药研发的一般规律及不同研究阶段的主要目的,开展针对性研究,落实药品全生命周期管理,促进中药传承与创新,保证药品安全、有效、质量可控,在研发过程中,药学研究要能够支持安全性和有效性研究的开展,同时不断积累药物信息,为上市时建立完善的质量控制体系提供数据支持。为鼓励中药传承创新发展,CDE自2018年6月召开启动会,确定指导原则的基本框架和基本要求,明确撰写工作分工等,历经多次专家会议讨论,形成征求意见稿,2020年7月20日上网征求意见一个月(2020年08月20日截止);2020年11月4日CDE正式发布实施《中药新药研究各阶段药学研究技术指导原则(试行)》(成文时间为2020年10月27日),该指导原则强调中药新药药学研究应遵循三个原则:
一是遵循中医药理论指导:尊重传统经验和临床实践,鼓励采用现代科学技术进行研究创新。
二是符合中药特点及研发规律:分阶段开展相应的研究工作,注重研究的整体性和系统性,提高新药的研发质量和效率,促进中药传承创新;
三是践行全生命周期管理:加强药材、饮片、生产工艺、质量标准等全过程的质量控制研究,建立完善符合中药特点的全过程质量控制体系,并随着对产品认知的提高和科学技术的不断进步,持续改进产品生产工艺、质量控制方法和手段,促进产品质量持续提升。
二、全生命周期药学研究重点内容
中药新药研究贯穿新药研发的全过程,应充分认识中药新药研发的渐进性,以满足临床需求为目标,药学研究逐步深入。研究者应不断加强质量控制研究,完善全过程质量控制体系,践行全生命周期管理,推动产品质量不断提升,保证药品安全、有效、质量可控。本指导原则主要针对中药新药申请临床试验、Ⅲ期临床试验前、申请上市许可及上市后研究各阶段需要完成的药学主要研究内容提出基本要求,为中药新药研究提供参考。
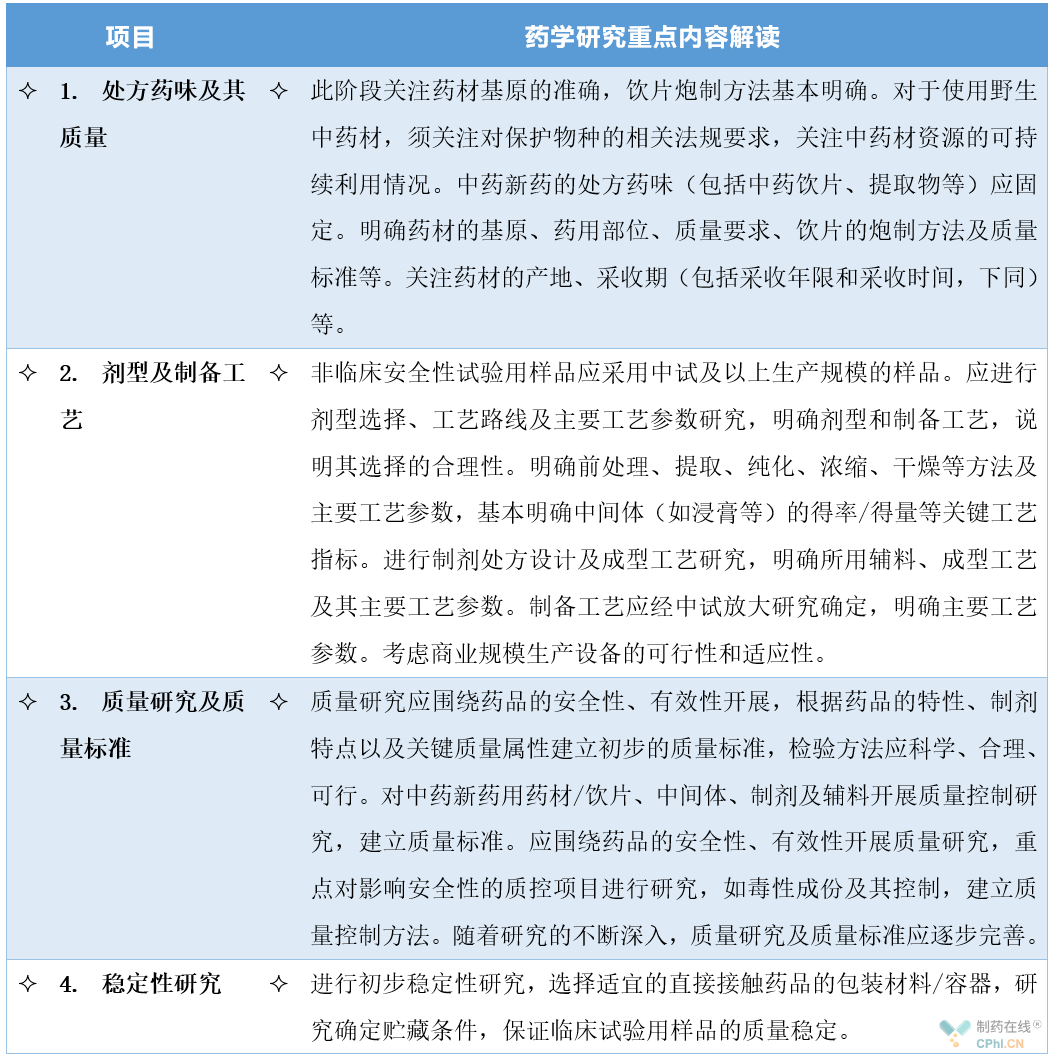
1、申请临床试验阶段
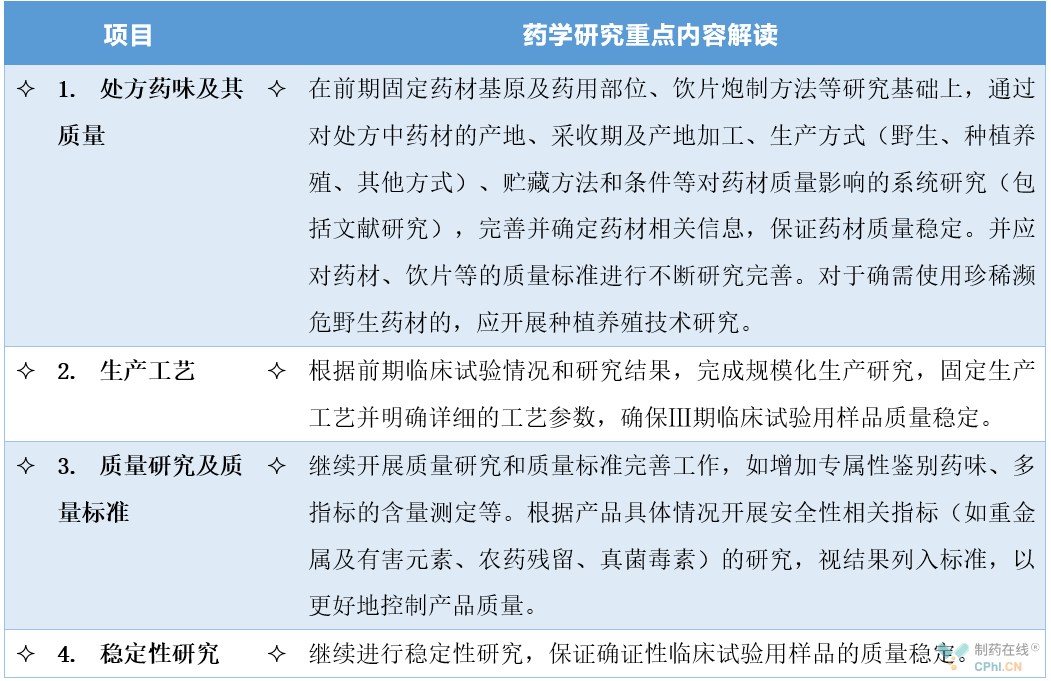
2、Ⅲ期临床试验前阶段
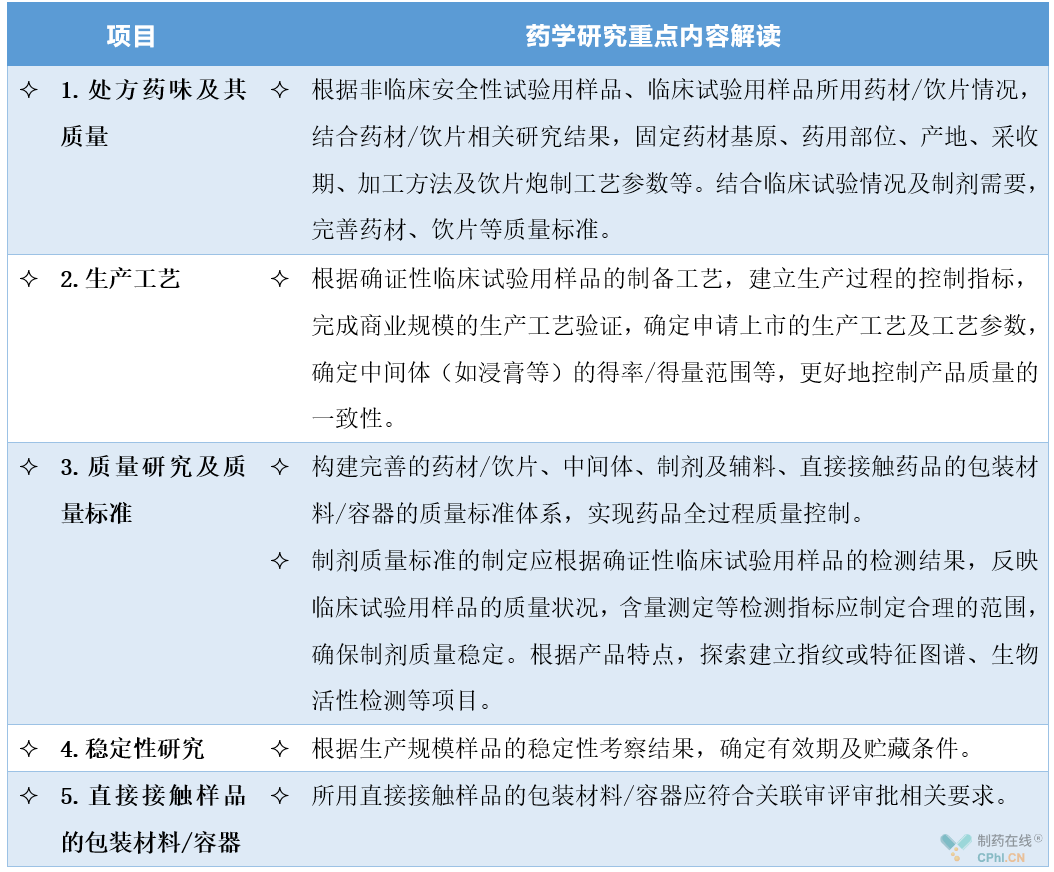
3、申请上市许可阶段
4、上市后研究阶段

参考文献
[1] http://www.cde.org.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57