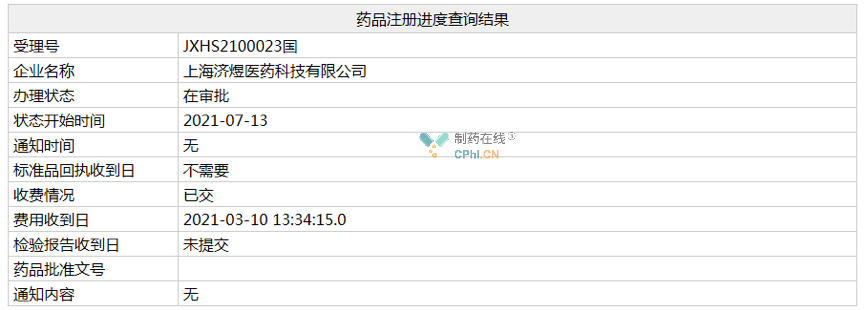
7月13日,太阳药业/济煜医药「磷酸索尼德吉胶囊」的5.1类进口申请(相关受理号为JXHS2100023)在NMPA的状态变更为“在审批”,预计不日将正式获批,批准的适应症为:手术或放疗后复发的局部晚期基底细胞癌(BCC)的成年患者,或不宜手术或放疗的患者。
基底细胞癌(BCC)是一种最常见的皮肤癌,约占非黑色素瘤皮肤癌的80%以上,常发于头颈部,鼻子是最常见部位。局部晚期BCC是指BCC从最初部位扩散至附近组织,约占BCC病例的1-10%。BCC通常可在早期阶段确诊并治疗,但约3%的患者在治疗5年后病情复发。由于人口老龄化、紫外线暴露增加等因素,BCC的发病率每年上升10%左右,预计其在全球范围内的发病率为0.003%-0.55%。
索尼德吉(sonidegib,Odomzo)是诺华研发的一种口服选择性Smoothened(SMO)抑制剂。2015年7月,该药被FDA批准用于不适合手术治疗或放射治疗的局部晚期BCC成人患者。2016年12月,太阳药业以1.75亿美元从诺华手中获得该药的全球权益。
Odomzo并不是获批治疗BCC的唯一一款SMO抑制剂。2012年2月,罗氏/基因泰克的SMO抑制剂Erivedge(vismodegib)被FDA批准用于不适宜手术或放疗治疗的有症状转移性BCC或局部晚期BCC成人患者。
Odomzo获批是基于一项名为BOLT的国际多中心、随机、双盲2期研究,该研究在局部晚期或转移性基底细胞癌成人患者中展开,评估Odomzo 200mg和800mg剂量的疗效和安全性。结果显示:200mg剂量组客观缓解率(ORR)为58%,其中完全缓解率(CR)为5%,部分缓解率(PR)为53%;实现客观缓解的患者中,有81%在随访至少1.9个月至18.6个月期间,仍然持续缓解。目前,中位缓解持续时间尚未达到。此外,无证据表明800mg剂量组ORR数据好于200mg剂量组。
在国内,索尼德吉被纳入《第一批临床急需境外新药名单》。2021年2月,索尼德吉在国内的上市申请获CDE受理,随后被纳入优先审批程序。此次获批,将为国内局部晚期或转移性基底细胞癌患者提供新的选择。
此外,值得一提的是,今年全球批准了一款BCC免疫疗法,即赛诺菲/再生元的Libtayo(cemiplimab)。Libtayo是一款PD-1单抗,2021年2月在美国被批准作为一种单药疗法,用于接受一种hedgehog通路抑制剂(HHI)治疗但病情进展或对该类药物不耐受的局部晚期或转移性BCC成人患者。
SMO是一种7次跨膜蛋白,是Hedgehog(Hh)信号通路中的关键蛋白。研究发现,Hh信号通路与众多癌症的发生、发展密切相关,在众多癌症疾病中,Hh信号通路表现为过度活化。除了上述已获批的两款SMO抑制剂,还有一款SMO抑制剂获批,即辉瑞的Glasdegib (Daurismo)。Glasdegib于2018年11月被FDA批准,联合低剂量阿糖胞苷,用于治疗新诊断的急性髓系白血病(AML)患者,这些患者年龄在75岁及以上或者由于身体原因不适合进行高强度化疗。
此外,据不完全统计,目前还有多款在研SMO抑制剂,如Taladegib、BMS-833923、LY2940680、Saridegib、TAK-441、GT1708F等。








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57