
在2020年7月7日,各大朋友圈、网络平台被一则"国家药监局关于发布《突破性治疗药物审评工作程序(试行)》等三个文件的公告"的消息疯狂刷屏,自发布之日(2020年7月7日)起施行,替代了原食品药品监管总局于2017年12月发布的《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),备受药界人士的关注,代表着三大加快上市注册的"利剑"正式落地,即突破性治疗药物程序、附条件批准程序、优先审评审批程序,本文对新《药品注册管理办法》下的三大加快上市注册制度进行了初步的解读。
一、三大加快上市注册的"利剑"政策背景分析
已上市的药品并不能满足临床需求,药品临床短缺成为新的监管难题,我国于2013年2年国家药监局发布《关于深化药品审评审批改革进一步鼓励药物创新的意见》首次提出了优先审评药品政策,直至新《药品注册管理办法》颁布前,优先审评审批程序已历经近七年的制度衍变,新《药品注册管理办法》在2020年7月1日正式生效,在第四章"药品加快上市注册"中首次将药品加快上市注册程序单独成章,并明确了四大加快上市注册程序,即突破性治疗药物程序、附条件批准程序、优先审评审批程序及特别审批程序,在新《药品管理法》背景下,为医药产业发展和公众用药安全有效提供极具价值的政策支持。
二、三大加快上市注册的"利剑"适用范围比较

三、三大加快上市注册的"利剑"适用条件比较

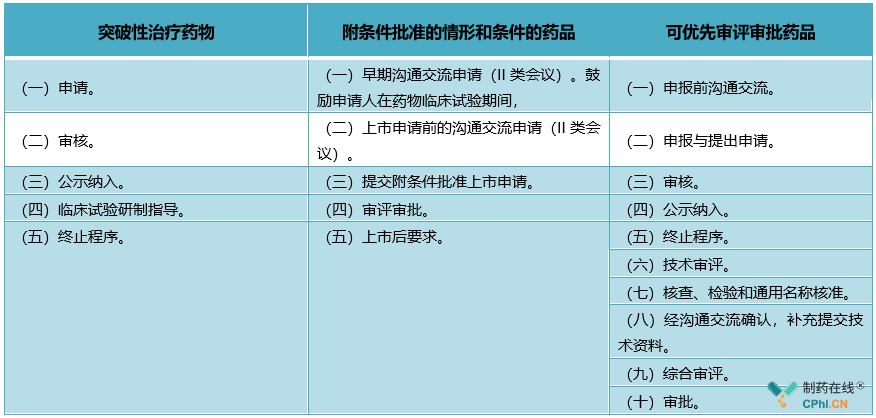
四、三大加快上市注册的"利剑"工作流程比较
参考文献
[1] www.nmpa.gov.cn/WS04/CL2138/378606.html



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57