https://www.cphi.cn 2023-10-30 15:58 来源:药渡Daily 作者:江篱
刚刚,君实生物(Junshi Biosciences)与Coherus BioSciences共同宣布,特瑞普利单抗(商品名LOQTORZI)在美国获FDA批准上市,成为FDA批准的第一个也是目前唯一一个用于鼻咽癌的PD-1单抗。
获批适应症
1)一线治疗特瑞普利单抗联用吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(R/M NPC)患者;
2)单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。

特瑞普利单抗本次获批是基于基于POLARIS-02研究(NCT02915432)及JUPITER-02研究(NCT03581786)两项临床研究结果。
POLARIS-02研究
POLARIS-02研究共纳入190例复发或转移性鼻咽癌患者接受特瑞普利单抗单药治疗,结果显示,在ITT人群中(N=190),客观缓解率(ORR)为20.5%,中位缓解持续时间(DOR)为12.8个月,中位总生存期(OS)为17.4个月;在92例既往接受过至少2线系统化疗失败的患者中,ORR为23.9%,中位缓解持续时间(mDOR)达到14.9个月,疾病控制率(DCR)为41.3%,中位总生存时间(mOS)达到15.1个月。2021年1月POLARIS-02研究在国际著名期刊《临床肿瘤学杂志》(Journal of Clinical Oncology,IF: 32.956)发表。

JUPITER-02研究
JUPITER-02研究是一项随机、双盲、安慰剂对照的国际多中心III期临床研究,旨在评估GP化疗联用特瑞普利单抗或安慰剂一线治疗复发/转移性NPC的疗效与安全性。
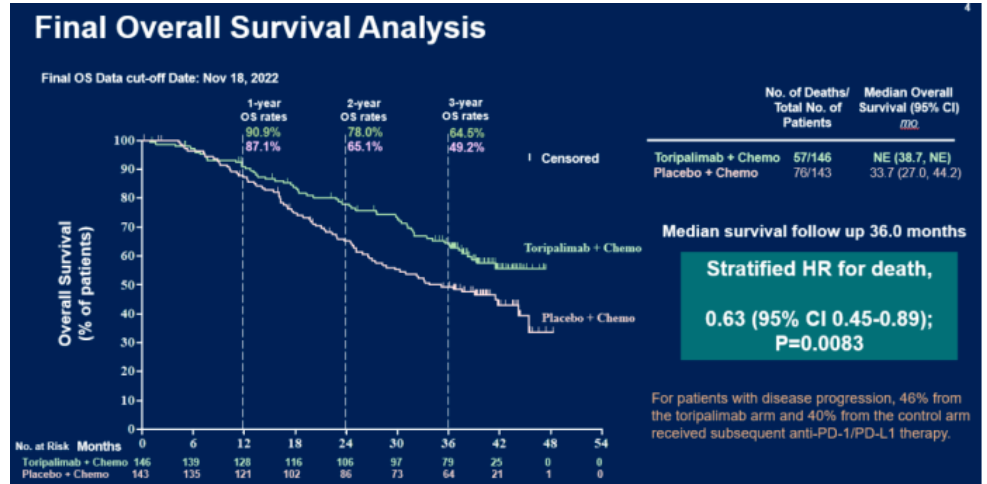
在2023年ASCO会议上最新数据显示,中位随访36.0个月,特瑞普利单抗组对比安慰剂组OS显著提高(NE vs 33.7个月,P=0.0083),死亡风险下降了37%(HR=0.63)。此外,特瑞普利单抗组的2年及3年OS率亦得到显著改善,分别达到78.0%和64.5%,而安慰剂组百分比为65.1%和49.2% 。
2022AACR大会上,JUPITER-02研究公布了PFS最终分析数据:截至2021年6月8日,中位PFS特瑞普利单抗联用化疗vs安慰剂组为21.4个月 vs 8.2个月,延长至近3倍(HR=0.52,95% CI 0.37-0.73,P<0.0001)。
交易合作
2021年君实生物与Coheru达成合作,根据协议条款,君实生物将授予Coherus特瑞普利单抗和两个可选项目(如执行)的许可,并获得总额最高达11.1亿美元的首付款、可选项目执行费和里程碑付款。君实生物将与Coherus共同开发特瑞普利单抗,由Coherus负责美国和加拿大的所有商业活动。君实生物将授予Coherus JS006(抗TIGIT单抗)和JS018-1(新一代改良IL-2细胞因子药物)的选择权,以及2个早期阶段检查点抑制剂抗体药物的优先谈判权。
2022年1月10日Coherus已启动行使JS006(君实生物自主研发的抗TIGIT单抗)在美国和加拿大的许可选择权的程序。在遵守适用法律及满足双方书面约定的条件的前提下,Coherus将向君实生物支付3500万美元首付款,最高达2.55亿美元的开发、申报和销售里程碑付款,以及产品销售净额18%的销售分成。
申报进展
2023年7月19日特瑞普利单抗联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗上市申请获NMPA受理。
2023年7月11日特瑞普利单抗联合阿昔替尼用于不可切除或转移性肾细胞癌(RCC)患者一线治疗的新适应症上市申请获NMPA受理。
2023年5月23日特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌(TNBC)的治疗的新适应症上市申请获NMPA受理。
2023年4月11日特瑞普利单抗联合化疗围手术期治疗并本品单药作为辅助治疗后巩固治疗,用于可切除III期非小细胞肺癌的治疗的新适应症上市申请获NMPA受理。
2022年11月24日向英国药品和保健品管理局(MHRA)提交特瑞普利单抗的上市许可申请。此次申报的适应症分别为:1)特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌(NPC)患者的一线治疗;2)特瑞普利单抗联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌(ESCC)患者的一线治疗。
2022年11月15日特瑞普利单抗向欧洲药品管理局(EMA)提交上市许可申请(MAA),适应症分别为:1. 特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌(NPC)患者的一线治疗;2. 特瑞普利单抗联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌(ESCC)患者的一线治疗。
获批里程碑
根据药渡数据调研,特瑞普利单抗目前已在黑色素瘤,鼻咽癌,尿路上皮癌,食管鳞癌及非小细胞肺癌多个适应症获NMPA批准上市。
2022年9月20日特瑞普利单抗注射液(拓益?)联合培美曲塞和铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗新适应症获得国家药品监督管理局(NMPA)批准。
2022年5月16日特瑞普利单抗注射液(拓益?)联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌(ESCC)患者的一线治疗新适应症获得国家药品监督管理局(NMPA)批准。
2021年11月,特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗获NMPA批准。
2021年4月,特瑞普利单抗用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗获NMPA附条件批准。
2021年2月,特瑞普利单抗用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗获NMPA附条件批准,这也是全球第一个获批治疗鼻咽癌的免疫疗法。
2018年12月17日,特瑞普利单抗获NMPA有条件批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030