https://www.cphi.cn 2024-04-19 11:20 来源:药渡仿制
Part 1
全球药物批准/研发动态
01
全球新药批准情况
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)全球(不含中国)共有6个新药获批上市。其中,NDA批准2个,新辅助疗法批准1个,新适应症批准2个,新剂型批准1个。与上个统计周期相比,本次减少3个批准新药。
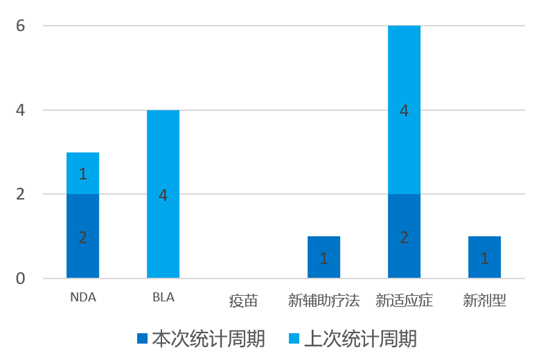
4月1日,FDA批准Voydeya(Danicopan)作为Ravulizumab或依库珠单抗的附加疗法,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人的血管外溶血症(EVH)。Voydeya是一种首 创的口服D因子抑制剂,已被FDA授予突破性疗法称号,并被欧洲药品管理局授予PRIority MEdicines(PRIME)资格。Voydeya还在美国、欧盟和日本被授予孤儿药资格,用于治疗PNH。
4月2日,Otsuka和Click宣布FDA已批准Rejoyn?用于治疗22岁及以上的成年MDD患者。这是美国第一个获准用于治疗重度抑郁症(MDD)症状的处方数字疗法。Rejoyn的批准是基于Mirai研究的数据,在完成为期六周的治疗计划一个月后,Rejoyn组的参与者表现出持续的改善。
全球(不含中国)新药批准情况(部分)


02
全球新药申报进展
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)全球(不含中国)共有4个新药申报上市。其中, BLA申报进展4个。与上次统计周期相比,本次增加1个NDA/BLA申报。
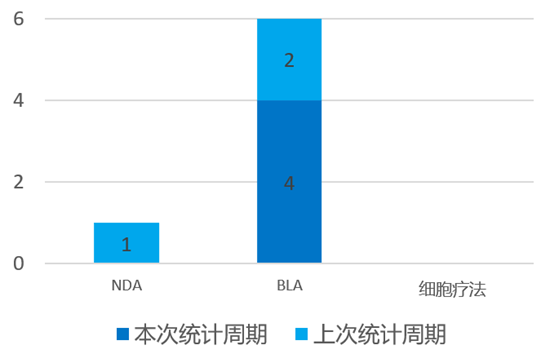
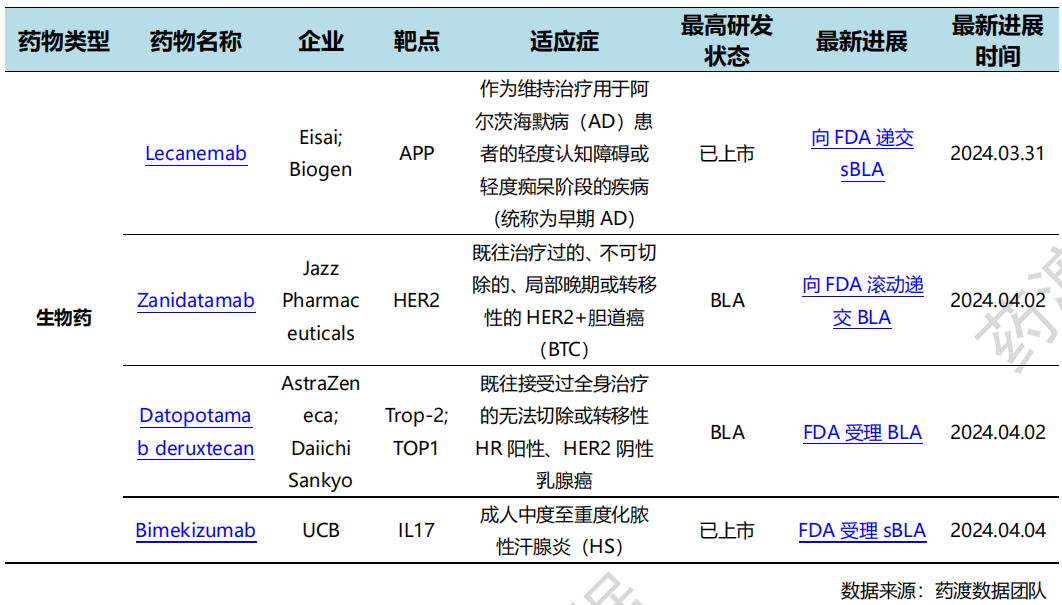
4月2日,阿斯利康和第一三共的Dato-DXd的BLA许可申请已在美国受理,用于治疗既往接受过全身治疗的无法切除或转移性HR阳性、HER2阴性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌成人患者。Dato-DXd是一种研究性TROP2靶向ADC。
NDA/BLA申报情况
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)全球(不含中国)共有1个药物获监管机构特殊资格认定。其中,生物药1个。与上次统计周期相比,本次减少3个获监管机构特殊资格认定的药物。
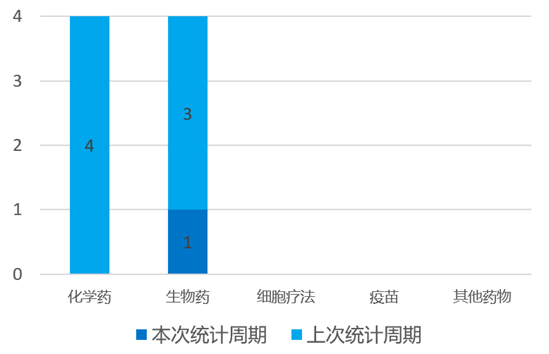
4月2日,荣昌生物宣布FDA授予泰它西普用于治疗干燥综合征的快速通道资格,已获批开展全球多中心III临床。原发性干燥综合征(pSS)是一种以侵犯泪腺和唾液腺等分泌腺为主的慢性炎症性自身免疫病,患者常出现口干、眼干、皮肤干的症状。目前,pSS尚无满意的治疗措施。泰它西普作为新型全人源TACI-Fc融合蛋白,通过重组DNA技术将B细胞表面受体TACI的胞外段与IgG1 Fc段连接制备而成,能同时结合BLyS和APRIL因子,抑制B细胞的成熟分化,减少自身抗体分泌,更好地控制疾病活动。
目前全球并无用作治疗干燥综合征的生物药获批,泰它西普有望成为干燥综合征突破性药物,填补这一领域的空白,为更多患者带来治愈希望。
特殊资格认定情况(部分)

03
全球新药研发进展
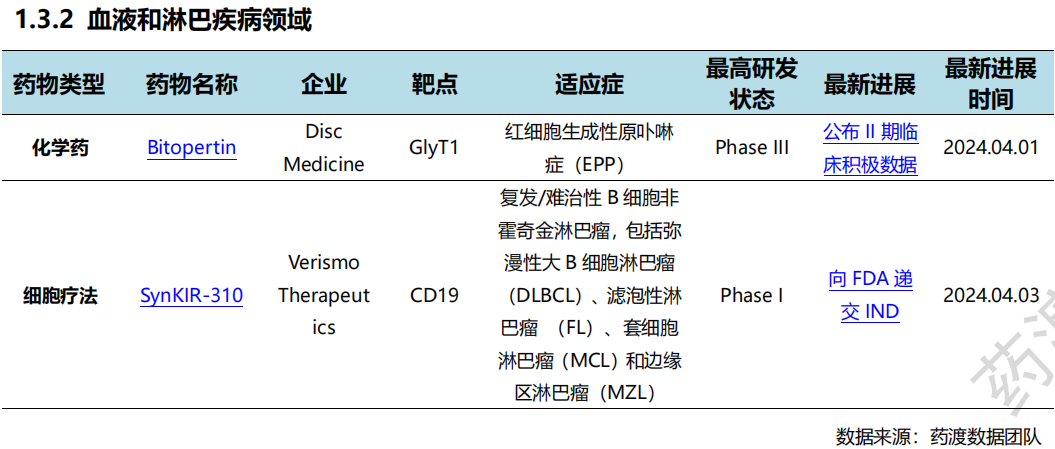
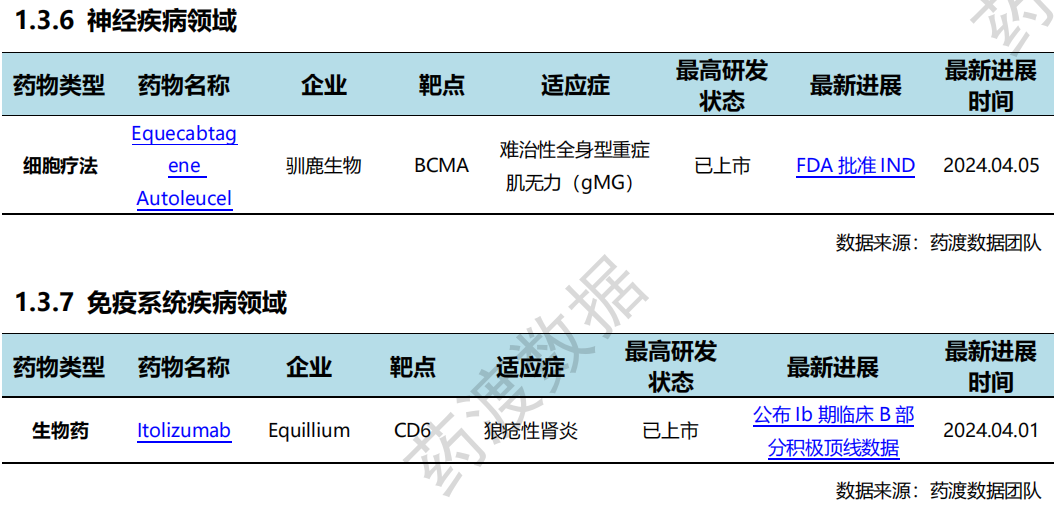
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)全球(不含中国)新药临床研发状态更新共计31条,涉及肿瘤、血液和淋巴疾病、遗传代谢病、精神疾病、免疫系统疾病以及眼部疾病等共计11个领域。
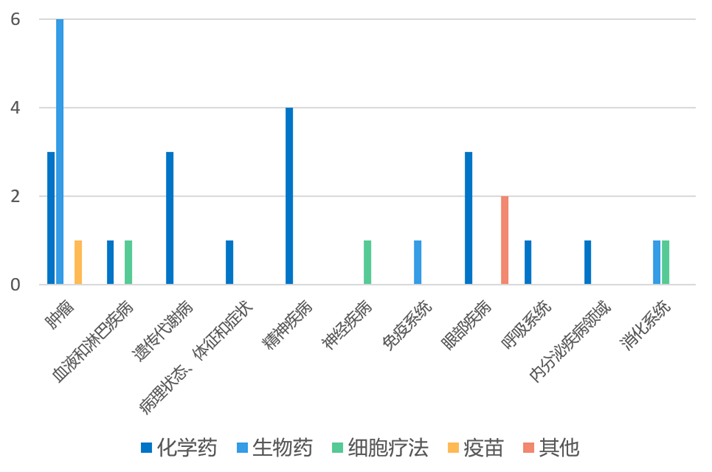
其中,肿瘤领域临床进展更新居各领域之首,涉及化学药3条,生物药6条,疫苗1条。
4月1日,GLOBE NEWSWIRE宣布于3月28日向FDA提交了研究性新药(IND)申请,开始CTIM-76的首次人体临床研究。IND支持启动CTIM-76在Claudin 6(CLDN6)阳性妇科和睾丸癌患者中的I期剂量递增和扩展临床试验。CTIM-76是一种CLDN6 x CD3 T细胞结合双特异性抗体,CLDN6 在多种实体瘤中富集。临床前研究表明,具有低免疫原性风险和可扩展生产的方便给药潜力,以解决大量可能符合CTIM-76治疗条件的患者。
4月4日,默沙东启动口服KRAS G12C抑制剂MK-1084与可瑞达?(帕博利珠单抗)联合用于转移性非小细胞肺癌患者一线治疗的III期临床试验。MK-1084与KEYTRUDA联合使用具有可控的安全性和抗肿瘤活性,该研究的主要终点是无进展生存期和总生存期,关键次要终点包括客观缓解率和缓解持续时间。
全球新药研发进展详情(部分)
04
全球医药交易事件
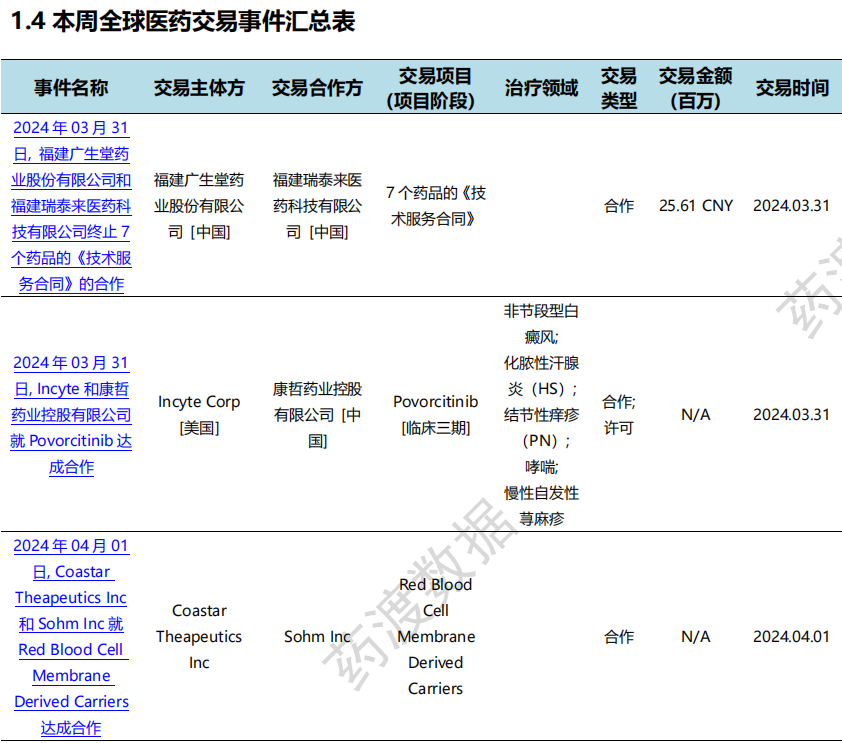
本次统计周期(2024.03.30-04.05)全球(含中国)医药交易时间共计12起,涉及药物权益转让、公司并购等多起交易事件。
全球医药交易时间汇总表(部分)
Part 2
国内药物批准/研发动态
01
国内新药批准情况
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内共有3个新药获NMPA批准上市。其中, 新适应症批准3个。与上次统计周期相比,本次增加3个NMPA批准新药。
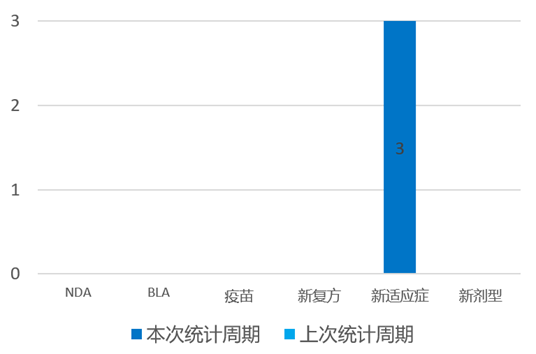
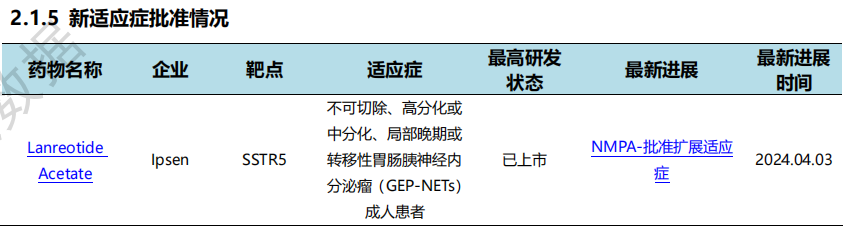
4月3日,Ipsen宣布醋酸兰瑞肽缓释注射液(商标名:索马杜林?)于3月29日经NMPA正式批准用于不可切除、高分化或中分化、局部晚期或转移性胃肠胰神经内分泌瘤(GEP-NETs)的成人患者,以改善无进展生存期,接受本品治疗时可减少短效生长抑素类似物应急治疗的频率。作为全球唯一获批可进行深部皮下自我注射的生长抑素类似物(SSA)类药物,索马杜林?确切的疗效、良好的安全性以及便捷舒适的注射体验为胃肠胰神经内分泌肿瘤患者带来更好的治疗选择,提升患者满意度。
索马杜林?是欧洲神经内分泌肿瘤学会(ENETS)及国内权威指南一致推荐的SSA治疗药物,可显著延长患者的无进展生存期(PFS)达38.5个月,疾病复发风险降低53%,适用人群广,临床证据全,循证等级高。
中国新药批准情况(部分)
02
国内新药临床默示许可进展
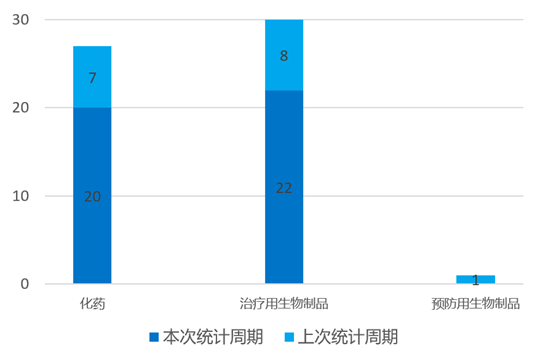
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内共有42个新药获临床默示许可,涉及70个受理号。其中,化学药20个,治疗用生物制品22个。与上个统计周期相比,本次增加52个临床默示许可获批受理号。
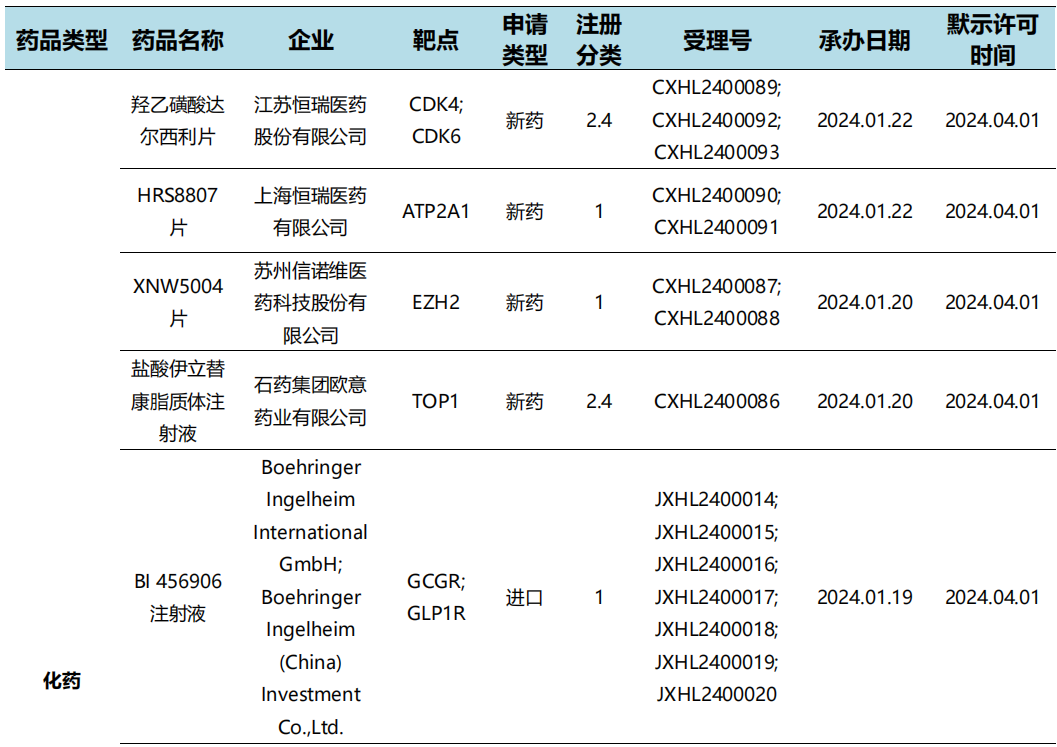
本周国内新药临床默示许可进展(部分)
03
国内新药申报进展
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内共有4个新药申报上市,涉及12个受理号。其中,化学药1个,治疗用生物制品3个。本次申报上市受理号数量与上个统计周期相同。
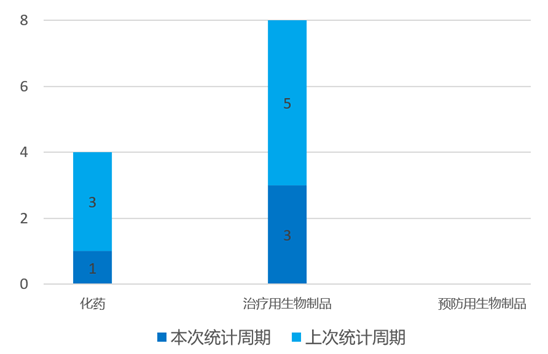
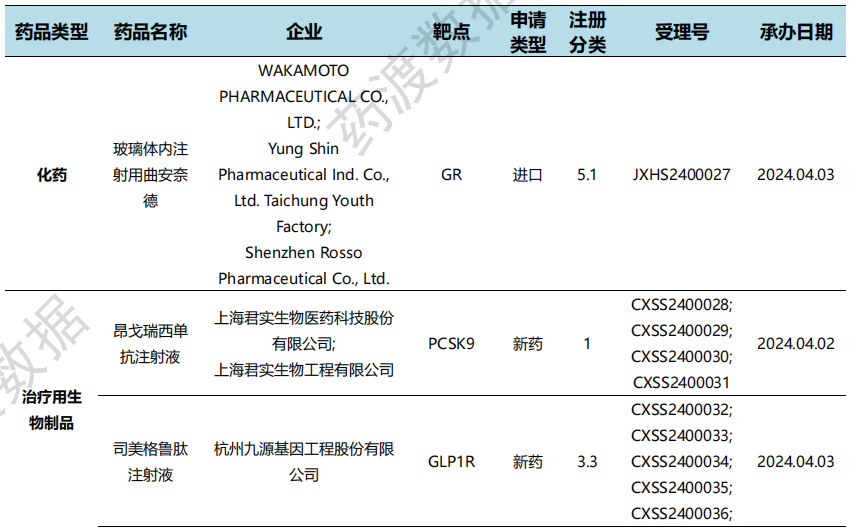
国内新药申报上市情况(部分)
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内共有23个新药申报临床,涉及36个受理号。其中,化学药16个,治疗用生物制品7个。与上个统计周期相比,本次减少5个临床申报受理号。
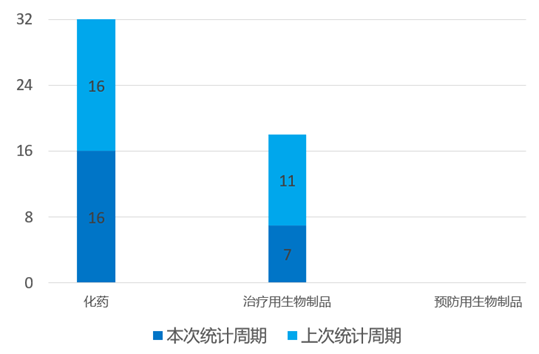
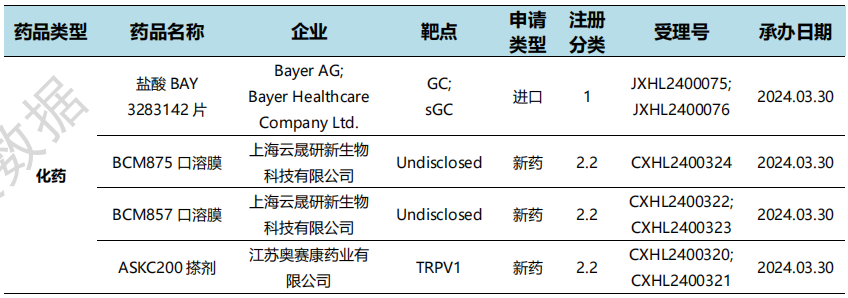
国内新药临床申报情况(部分)
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内共有1个药物获NMPA特殊资格认定。其中,生物药1个。与上个统计周期相比,本次减少4个获监管机构特殊资格认定的药物。
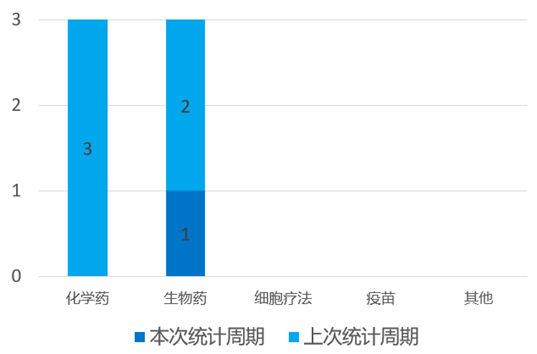
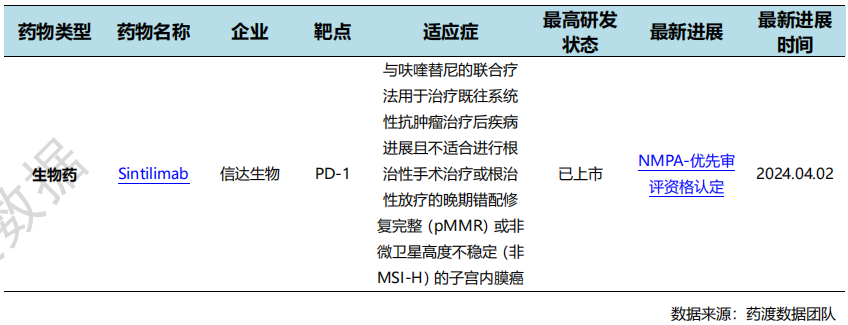
4月2日,罗克维尔、信达生物、和黄医药联合宣布:信迪利单抗与呋喹替尼的联合疗法用于治疗既往系统性抗肿瘤治疗后疾病进展且不适合进行根治性手术治疗或根治性放疗的晚期错配修复完整(pMMR)或非微卫星高度不稳定(非MSI-H)的子宫内膜癌患者的新药上市申请,已获NMPA受理并予以优先审评。
RUSICA-1是一项多中心、开放标签的II期临床试验的子宫内膜癌注册队列,旨在评估信迪利单抗联合呋喹替尼治疗含铂双药化疗治疗后疾病复发、疾病进展或出现不可耐受的毒性的子宫内膜癌患者。研究的主要终点是独立审查委员会(IRC)评估的客观缓解率(ORR),次要终点包括疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和药代动力学评估。
NMPA特殊资格认定情况(部分)
04
国内新药研发进展
根据药渡数据统计分析,本次统计周期(2024.03.30-04.05)国内新药临床研发状态更新共计2条,涉及心血管疾病和皮肤病共计2个领域。其中,化学药1个,生物药1个。
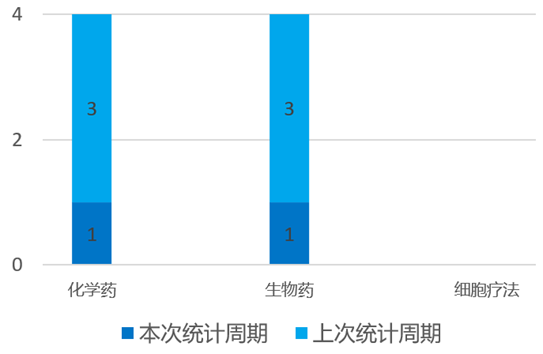
4月1日,靖因药业宣布其自主研发的新型抗凝小核酸药物SRSD107注射液国内I期临床试验顺利完成首例受试者给药。SRSD107注射液是双链小干扰核酸(siRNA)药物。通过特异性肝靶向凝血因子XI(FXI)mRNA,抑制FXI的蛋白表达,阻断内源性凝血途径的激活,从而达到抗凝血/抗血栓的作用。临床前试验数据显示,单次皮下注射SRSD107,可实现几乎100%敲低FXI表达的效果,且持续时间达半年之久,同时未见出血。
SRSD107也同步在澳大利亚开展I期临床,已完成前两个剂量组受试者的入组给药,目前进展顺利。
国内新药研发进展情况(部分)

05
国内新药研发领域政策法规动态
关于公开征求《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则(征求意见稿)》意见的通知
为指导我国司美格鲁肽注射液生物类似药的临床研发,提供可参考的技术标准,药品审评中心组织撰写了《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。
06
国内新药研发领域热点新闻
复星医药:艰难突围的一年
近日,复星医药发布最新年报,2023年,其总营收414.00亿元,其中制药板块营收302.22亿元,同比下降1.91%。从数据上看,营收净利双降,不太乐观。复星医药董事长吴以芳在2023年度线上业绩说明会上也承认,“这确实是复星医药非常艰难的一年”。但就在这艰难的一年里,通过焦点重新定位,复星医药还是取得了很不错的成绩,并非全线溃败。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030