https://www.cphi.cn 2018-10-18 08:03 来源:CPhI制药在线 作者:话医
美国当地时间2018年10月16日,FDA批准辉瑞抗癌新药talazoparib(TALZENNA,Pfizer Inc.),一种聚(ADP-核糖)聚合酶(PARP)抑制剂,用于有害或疑似有害生殖系BRCA突变(gBRCAm),HER2阴性局部晚期或转移性乳腺癌的患者,推荐剂量为1毫克,每日口服一次。Talazoparib成为FDA批准的第四款PARP抑制剂。2018年6月8日,talazoparib获得优先审批资格,从提交IND到获批上市历时不到70天。

本次批准是基于EMBRACA的一项开放标签试验。随机选择431名患者(2:1)患有gBRCAm HER2阴性局部晚期或转移性乳腺癌,接受talazoparib(1 mg)或医生选择的化疗方案(卡培他滨,艾日布林,吉西他滨,或长春瑞滨)。要求所有患者都具有已知的有害或疑似有害gBRCA突变,并且必须接受不超过3种针对局部晚期或转移性疾病的细胞**化疗方案。在新辅助治疗,辅助治疗和/或转移治疗中,患者需要接受蒽环类和/或紫杉烷治疗(除非是禁忌)。试验根据实体瘤反应评估标准(RECIST)1.1,采用盲态独立中心评价方法,对无进展生存期(PFS)等主要疗效结果进行评估。结果表明,talazoparib和化疗组的中位PFS分别为8.6和5.6个月(HR 0.54; 95%CI:0.41,0.71; p <0.0001),无进展生存期(PFS)显著延长,talazoparib可将疾病进展风险降低了46%。另外,talazoparib组的客观缓解率为62.6%,是化疗组(27.2%)的两倍以上(p<0.0001)。
处方信息包括骨髓增生异常综合征/急性髓性白血病,骨髓抑制和胚胎-胎儿**的警告和预防措施。同时,任何等级的最常见(≥20%)不良反应是疲劳,贫血,恶心,中性粒细胞减少,头痛,血小板减少,呕吐,脱发,腹泻,食欲减退。
FDA还批准了BRACAnalysis CDx检测(Myriad Genetic Laboratories,Inc.),以鉴定患有有毒或疑似有害gBRCAm的乳腺癌患者使用talazoparib。 BRACAnalysis CDx检测的有效性基于EMBRACA试验人群,其中使用BRACAnalysis CDx进行前瞻性或回顾性检测确认有害或疑似有害gBRCAm状态。
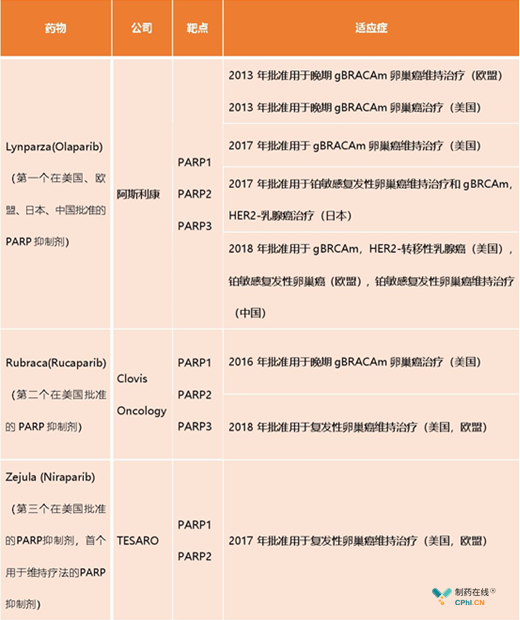
在这之前,FDA已批准3个PARP抑制剂药物上市,分别为阿斯利康公司的Olaparib、Clovis公司的Rubraca、TESARO和默沙东公司的Zejula。
Lynparza (Olaparib)
2014年12月19日, FDA批准阿斯利康公司的Lynparza上市,用于铂敏感复发性BRCA突变卵巢癌成人患者的维持治疗,该药也成为用于BRCA突变铂敏感复发性卵巢癌的首个PARP抑制剂。同年6月,欧盟委员会(EC)已批准Lynparza作为一种单药疗法,用于卵巢癌成人患者的维持治疗。也是唯一在中国批准的PARP抑制剂。
Lynparza是一种首创口服聚ADP核糖聚合酶(PARP)抑制剂,其具有治疗DNA修复缺陷型多种肿瘤的潜力,尤其用于乳腺癌和卵巢癌的治疗,阿斯利康正开展多个III期研究,用于BRCA突变引起的卵巢癌、胃癌、乳腺癌治疗。临床研究已经证实,Lynparza可显著延长携带生殖系BRCA突变(gBRCA)、复发且对铂类药物的化疗无反应的卵巢癌病人的无进展生存期(PFS)。
Rubraca (Rucaparib)
2016年12月19日, FDA批准Clovis公司的Rubraca上市,用于经过两线或两线以上化疗的和BRCA基因突变相关的晚期卵巢癌,该药是继2014年阿斯利康Lynparza后第二个在美国上市的PARP抑制剂。
Rubraca的安全性和疗效是通过两项单臂临床试验涉及106例有BRCA突变的晚期卵巢癌(曾使用两种或多种化疗方案治疗)患者得出的,在该试验中,54%患者实现持续中位时间9.2个月的肿瘤完全或部分收缩。
FDA曾授予Rubraca优先审评和突破性药物治疗的资格认定,同时还获得了孤儿药物的认定。该药的机会亮点是单药用于乳腺癌单药。
Zejula(Niraparib)
2017年03月27日,FDA批准TESARO及默沙东公司共同研发的Zejula上市,用于复发性上皮卵巢癌、输卵管癌或原发性腹膜癌女性患者的维持治疗。
Zejula曾获得FDA加速审批、优先审批、突破性药物多重身份,是第三个上市的PARP抑制剂,同时是美国FDA批准的首个无需BRCA突变或其他生物标志物检测就可用于治疗的PARP抑制剂,其没有BRCA变异限制,适用人群更为广泛。
聚(ADP-核糖)聚合酶(PARP)是一种DNA修复酶,是DNA修复和保持染色体完整性的关键酶。DNA损伤断裂时会激活PARP,它作为DNA损伤的一种分子感受器,具有识别、结合到DNA断裂位置的功能,进而激活、催化受体蛋白的聚ADP核糖基化作用,参与DNA的修复过程。
BRCA1和BRCA2是产生参与DNA修复的蛋白质的人类基因。当其中任一基因发生突变时,DNA修复就可能无法正常进行,会导致某些类型癌症(如乳腺癌)的发生。携带BRCA1或BRCA2种系基因突变的癌症患者体内的肿瘤携带着特定的DNA修复缺陷,这样就对同样能阻碍DNA修复的PARP抑制剂尤其敏感。
BRCA突变可以是遗传性(生殖细胞)或自发性(体细胞)。BRCA1和BRCA2突变约占遗传性乳腺癌约25%-30%,和所有乳腺癌5%-10%。据估计,约72%的具有遗传性BRCA1突变的人,和约69%的具有BRCA2突变的人,会在80岁前患上乳腺癌。流行病学研究表明,gBRCAm乳腺癌患者的平均年龄为40-45岁,比整体乳腺癌人群的患病年龄短了20年。这些年轻的患者急需有效疗法来缓解疾病,延长生命。同时PARP抑制剂在胃癌、胰 腺 癌、前列腺癌和卵巢癌等其它携带着特定DNA修复缺陷的肿瘤潜在市场更大。除了获批产品外,百济神州、Oncology、艾伯维、恒瑞、梯瓦、上海药物所、英派、青峰、人福等国内外公司都有相关产品布局,PARP抑制剂已成为抗癌领域的一个热门领域。
信息来源:FDA官网,药明康德,药渡网
话医:医药吃瓜群众,邮箱670860544@qq.com,欢迎留言讨论。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030