https://www.cphi.cn 2023-05-17 10:22 来源:CPHI制药在线 作者:滴水司南
2023年4月21日,国家药监局食品药品审核查验中心官网重磅发布了"关于公开征求《麻 醉药品、精 神药品和药品类易制 毒化学品生产质量管理指导原则》意见的通知"(成文时间:2023年4月21日),会稿截止日期2023年5月9日。该指导原则旨在为加强麻 醉药品、精 神药品和药品类易制 毒化学品(以下简称"特殊药品")的生产质量管理,明确特殊药品生产的安全管理技术要求,也可作为监管机构开展各类现场检查的重要参考,进一步完善特殊药品监管长效机制。本文对《麻 醉药品、精 神药品和药品类易制 毒化学品生产质量管理指导原则》中生产质量管理关键要点进行了分析。
一、"特殊药品GMP"修订背景
党中央、国务院对禁毒工作高度重视,特殊管理药品监管作为禁毒工作的重要组成部门,必须提升管理要求,确保安全。为防止特殊管理药品和具有特殊活性的物质从生产环节丢失或流入非法渠道,需要结合实际存在的问题,细化和完善对特殊管理药品供应链安全管理、生产管理和质量控制的要求,笔者管理了相关法规的制订背景,如有遗漏,欢迎大家留言补充。
1) 2017年10月12日,原食品药品监管总局办公厅发布"公开征求药品生产质量管理规范麻 醉药品精 神药品和药品类易制 毒化学品附录(征求意见稿)意见"(成文日期:2017年10月12日),被业界简称为《特殊管理药品GMP附录》,该附录共有七章39条,包括范围、原则、机构与人员、厂房设施与设备、供应链安全管理、生产管理和质量控制、术语,明确特殊管理药品注册批准前样品试制或批量生产、以特殊管理药品为原料生产普通药品原料药或复方制剂等有供应链安全管理和生产管理与质量控制特殊要求的关键环节,按照本附录执行。
2) 2018年6月7日,国家药品监督管理局办公室再次发布"公开征求药品生产质量管理规范麻 醉药品精 神药品和药品类易制 毒化学品附录(征求意见稿)意见"(成文日期2018年5月31日),征求意见截止日期2018年6月30日,国家药品监督管理局研究并采纳了2017年10月12日征求意见稿的部分意见,对《附录》进行了修改和补充。
3) 2023年4月21日,国家药监局食品药品审核查验中心官网重磅发布了《麻 醉药品、精 神药品和药品类易制 毒化学品生产质量管理指导原则》(征求意见稿)又一个新的GMP级别指导原则即将发布,明确特殊药品上市许可持有人(含原料药登记人)和生产企业的原料采购、生产管理、质量控制与质量保证、储存、运输、召回、销售、废弃物及特殊活性物质处理等生产全过程应当符合国家相关规定和《药品生产质量管理规范》及附录要求,其中涉及特殊药品特别要求的,还应符合本指导原则要求。
二、特殊药品全生命周期质控要点
2.1特殊药品有哪些?
根据《中华人民共和国药品管理法》和国务院的有关规定,国家对麻 醉药品、精 神药品、医疗用毒 性药品、放 射 性药品,实行特殊管理,对药品类易制 毒化学品、戒毒 药品和兴奋剂也实行一定的特殊管理,特殊药品GMP指导原则旨在为加强麻 醉药品、精 神药品和药品类易制 毒化学品的生产质量管理,那么这三种特殊药品如何定义呢?

2.2明确"特殊药品GMP"适用范围和扩展范围

2.3"特殊药品"机构与人员有哪些特殊考虑?
企业应当设立安全管理机构和安全管理受权人,规定机构设置和人员配备原则以及安全管理受权人资格条件和职责,并要求对接触特殊管理药品和特殊活性物质的所有人员进行培训并建立档案。

2.4"特殊药品"厂房、设施与设备有哪些特殊考虑?
对共线或共用设备生产特殊管理药品进行风险评估,确认不会产生污染和交叉污染;根据特殊管理药品产品特性及安全风险,采用相应的储存和安全监控设施设备。

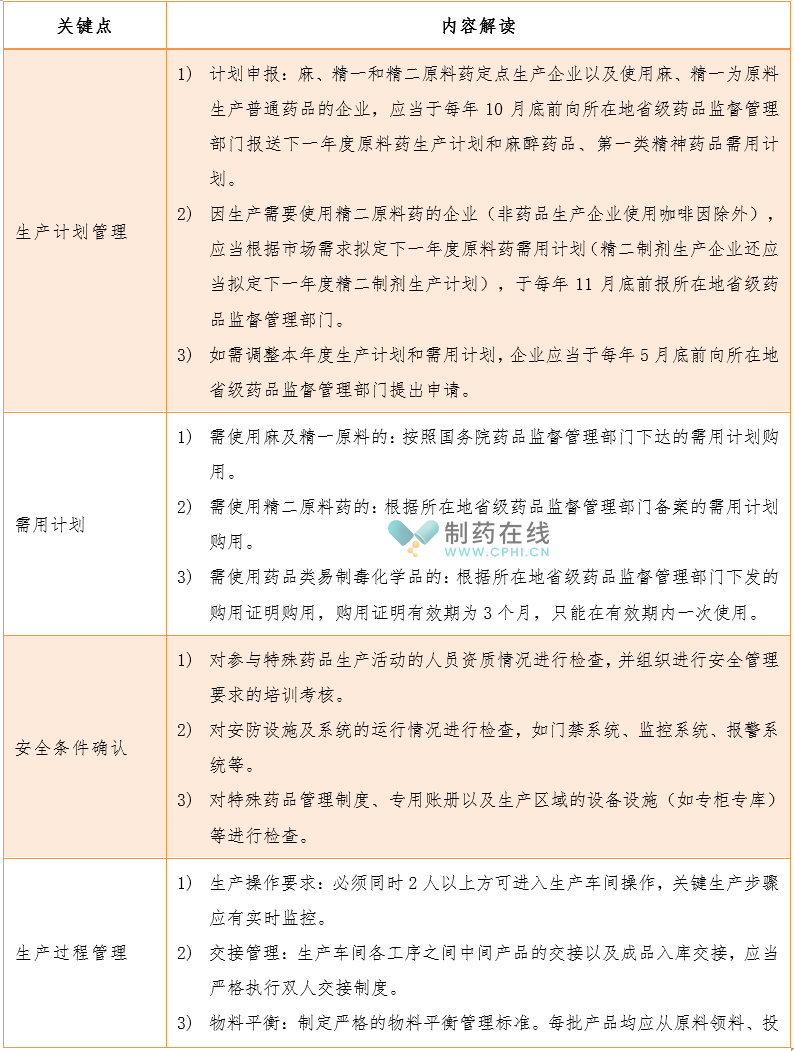
2.5"特殊药品"生产管理和计划管理有哪些特殊考虑?
明确生产/需求计划管理、安全条件确认制度、生产过程管理等特殊管理要求。

2.6"特殊药品"质量控制和质量保证有哪些特殊考虑?
明确特殊药品的取样、留样、发样、退样管理制度、异常情况处理、追溯管理等特殊管理要求,并定期对安全管理数据进行回顾,实现可追溯性管理。

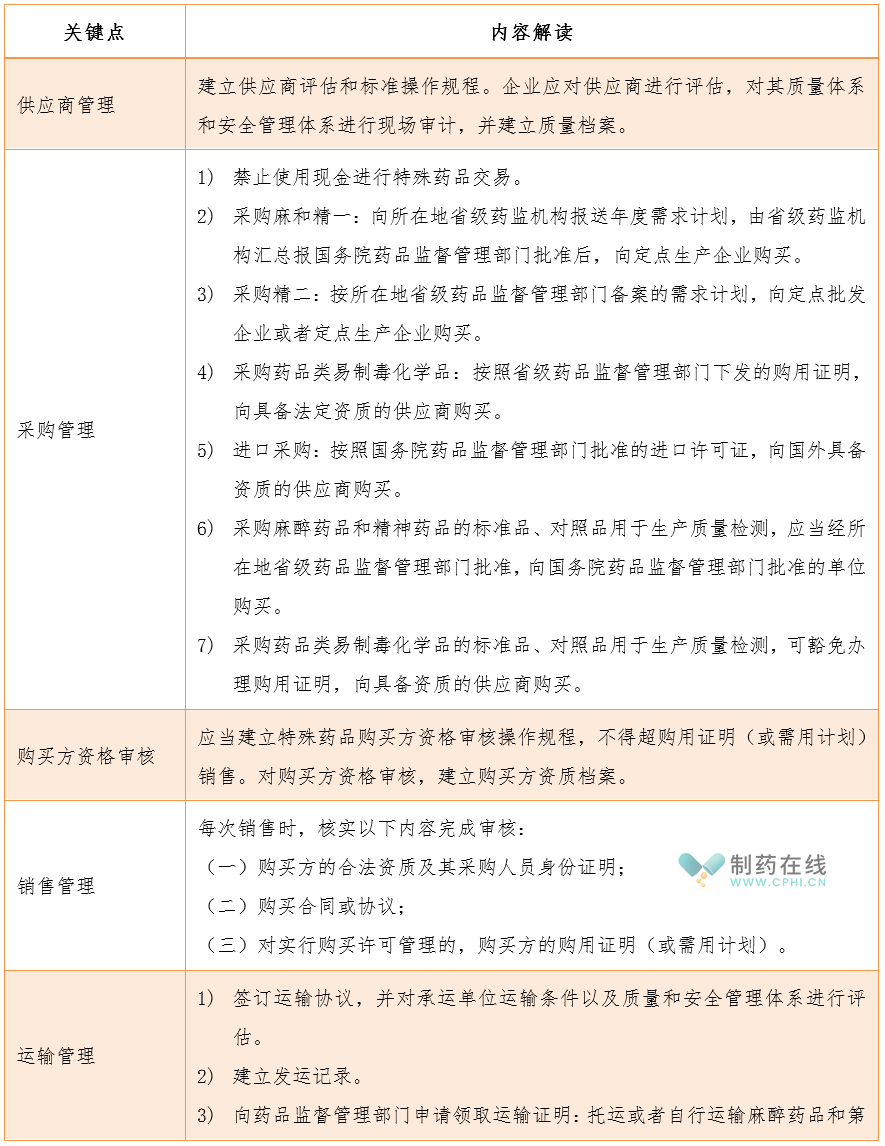
2.7"特殊药品"供应链安全管理有哪些特殊考虑?
要求建立覆盖物料采购、储存和领用,产品管理和回收、返工、重新加工,成品销售发运、退货和召回等全过程的供应链安全管理体系,明确购进、销售和发运管理要求,要求在供应链安全管理的各个环节均应建立专用账册和记录,用信息化手段记录和保存信息。
2.7.1"特殊药品"采购与销售有哪些特殊考虑?

2.7.2"特殊药品"储存管理有哪些特殊考虑?

2.7.3"特殊药品"退回、召回与销毁有哪些特殊考虑?

2.7.4"特殊药品"安全保卫有哪些特殊考虑?

参考文献
[1] NMPA等
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030