https://www.cphi.cn 2023-11-08 11:20 来源:药智网
政策药闻
CDE新增7条《常见一般性技术问题解答》
10月26日,国家药监局药品审评中心官网“信息公开”栏目更新7条共性问题,其中2条涉及化学原料药上市申请登记,4条涉及仿制药质量和疗效一致性评价,1条涉及药物临床试验登记信息变更。
问题详情包括:
化学原料药上市申请登记审评期间能否变更登记人主体?
境外生产化学原料药上市申请登记资料中,是否需要提供证明文件更新的承诺?
《仿制药质量和疗效一致性评价受理审查指南》的修订背景是什么?
以及一系列企业日常中常见的疑问,CDE官方均做出详细回复。
CDE发布《化药参比目录(第75批)》(征求意见稿)
10月24日,国家药监局药审中心发布《化学仿制药参比制剂目录(第七十五批)》(征求意见稿),其中共有14个品规首次进入了目录,增补了68品规药品以及既往批次16品规药品增加上市许可持有人,共计84个化学仿制药参比制剂增补目录。
另外还有39个品规药品未通过审议主要原因包括不具备参比制剂地位、不属于欧美日等监管体系完善国家批准的原研药以及安全有效数据不充分等。
参比制剂作为仿制药质量和疗效一致性评价的对照药品来源,其目录品种应为处方工艺合理、质量稳定、疗效确切的药品。此次化药参比目录的发布也预示着更多仿制药品种的来临。
无参比制剂品种迎来仿制
10月13日,国家药监局、CDE分别发布公告,对无参比制剂品种仿制研究技术、申报资料提出明确要求。
国家药监局发布《关于无参比制剂品种仿制研究的公告(2023年第130号)》(以下简称《公告》)及相关《政策解读》。
《政策解读》中明确:境内外已有公开数据,以及之前公示的《临床价值明确,无法推荐参比制剂的化学药品目录》中所说的“临床价值明确”,不能作为自证临床价值的证据。基于无参比制剂品种的特点,必须坚持高标准、严要求,通过临床试验确证该品种的临床价值。
申请人完成临床试验后,应按照现行化学药品申报资料要求递交相关资料。获得的临床试验结果能够证明临床价值的无参比制剂品种,予以批准。不满足上述情况的,不予批准。
慢病毒载体RCL检测问题与解答(征求意见稿)发布
10月13日,CDE发布《慢病毒载体RCL检测问题与解答(征求意见稿)》,以进一步促进细胞和基因治疗产品的发展,并规范和指导企业慢病毒载体RCL检测方法开发。
据文件中提及,由于我国目前尚未颁布针对RCL 检测的针对性技术指南,因而在检测样品、检测量、检测方法和方法学验证等方面存在诸多共性问题。故此形成初步建议,供申请人参考。
其中有几项重点内容值得提及:
一者,建议每个临床试验用批次的病毒载体上清液和生产终末细胞 (EOPC) 均需要采用细胞培养法进行 RCL 检测;
二者,检测样品优先选择未处理的病毒上清液,也可以考虑选择经过浓缩处理的病毒上清液或病毒成品进行 RCL检测,但要求也更多;
三者,还有针对病毒上清液取样量计算应按照现行 FDA 指南中计算公式等等诸多要点内容。
《关于加强委托生产药品上市许可持有人监管工作的通知》发布
10月23日,NMPA发布了“国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告(2023年第132号)”,内容上是对今年5月发布的“关于加强委托生产药品上市许可持有人监管工作的通知(征求意见稿)”的补充与完善,更新了对MAH委托生产的要求。
内容上主要围绕严格委托生产的许可管理、强化委托生产的质量管理、强化委托生产的监督管理等几大重点方向进行。细节上的主要变化有,新增关键岗位人员在职在岗情况、申请人质量管理体系运行情况,新增无菌药品生产负责人的要求,明确了受托生产企业接受检查的流程等等。
BD动态
跨国BD交易情况出海脚步加快
从数据上来看,今年以来license out的交易项要明显大于license in,总体显示中国药企“出海”脚步正在逐步增大。10月以来,BD交易的该规律更是尤为凸显。
首先,2023年10月医药资本市场交易中,共有7项跨国BD交易,其中license in分别为2笔,license out分别为5笔。
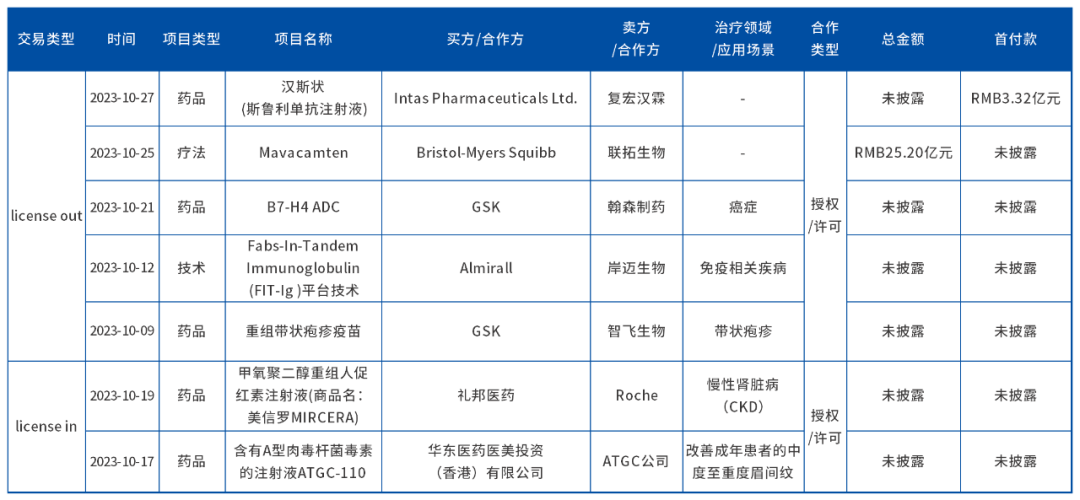
3.5亿美元!联拓生物与百时美施贵宝 达成授权合作
10月24日,联拓生物(LianBio)宣布,该公司已与百时美施贵宝公司签订协议,授予后者在大中华区(中国大陆、香港、澳门和台湾地区)、新加坡、泰国开发和商业化mavacamten的独家权利。
根据协议条款,联拓生物将获得一次性3.5亿美元的对价。此外,根据联拓生物此前与MyoKardia签订的许可协议,而需向其支付的1.275亿美元的剩余里程碑付款义务也将被豁免。
复宏汉霖与Intas联手进军欧洲、印度市场,加速H药海外布局
10月27日,复宏汉霖(2696.HK)宣布与Intas Pharmaceuticals Limited (以下简称“Intas”)达成合作,授予其在欧洲和印度对复宏汉霖自主开发的抗PD-1单抗 H药 汉斯状?(斯鲁利单抗)包括广泛期小细胞肺癌(ES-SCLC)在内的多项适应症及特定剂型进行独家开发和商业化的权利。
合作可谓为H药全球布局打开崭新的发展机遇。根据协议,复宏汉霖将负责H药在欧洲和印度的临床开发及上市后的产品生产和供应,并将从此次交易中获得4200万欧元的首付款、可达4300万欧元的监管里程碑付款、可达1亿欧元的商业化里程碑付款及两位数比例的合作区域净利润特许权使用费。
其次,海外市场方面,跨国MNC企业的交易也异常频繁,单月交易金额突破300亿美元,大肆吸取全球前沿项目。
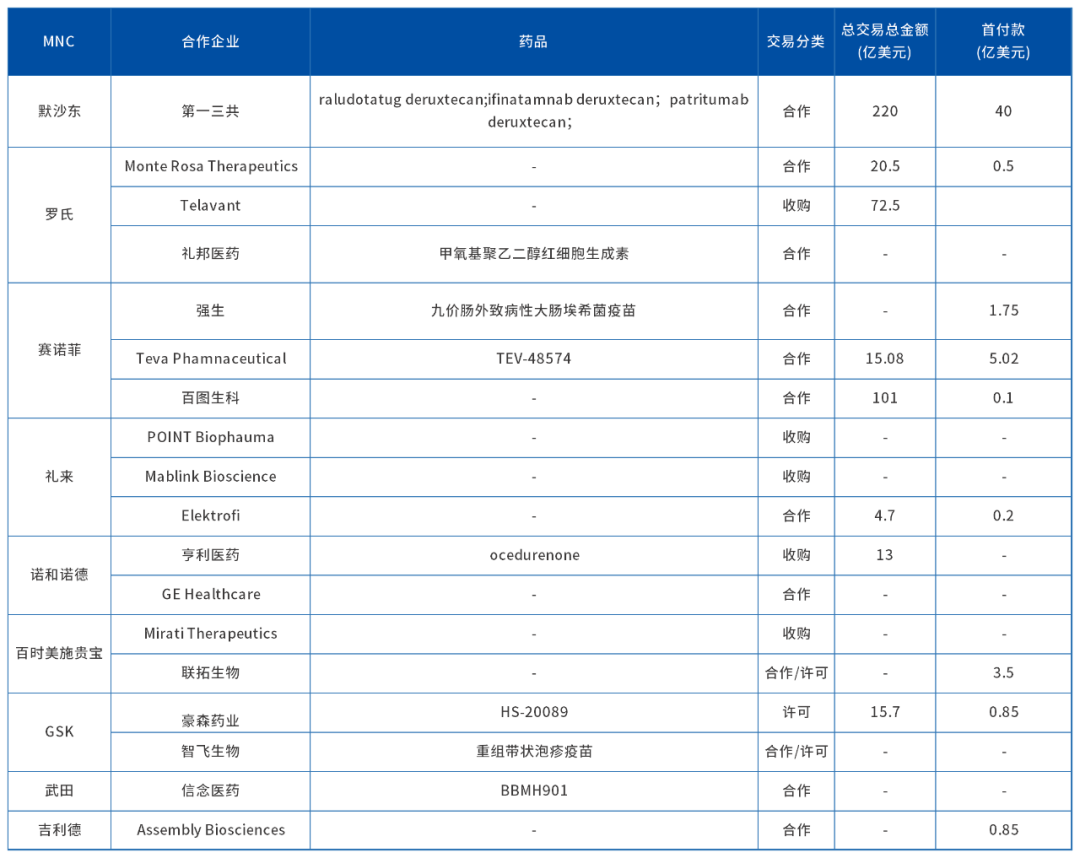
10月最大交易,默沙东ADC版图再扩张
10月19日,第一三共和默沙东就三种抗体药物偶联物 (ADC) 签订了全球开发和商业化协议,两者将在全球范围内共同开发这些 ADC 候选药物,并可能将其商业化;第一三共将全权负责药物制造和供应,并保留在日本范围内的独家权利。
根据协议条款,默沙东将向第一三共支付 40 亿美元的预付款以及未来 24 个月内 15 亿美元的持续付款,并可能根据未来销售里程碑的实现情况额外支付最多 165 亿美元,总共约220 亿美元。
第一三共开发了HER3 ADC药物Patritumab Deruxtecan(U-1402),并于2016年开展临床Ⅰ期研究。目前其已处于临床Ⅲ期阶段,并计划于2024年3月底在美国递交生物制品许可申请(BLA)。
赛诺菲10亿美元,入局IBD
本月赛诺菲的三项合作中,最引人注目的当属与Teva就用于治疗炎症性肠病(IBD)的TL1A单抗TEV-574达成了共同开发的合作协议。
根据协议,Teva将获得4.6亿欧元(约5亿美元)预付款(本月第二),以及最高达9.4亿欧元(约10亿美元)的里程碑付款。赛诺菲将领导该疗法3期项目的开发;Teva将在欧洲、以色列和指定的其他国家地区主导产品的商业化,赛诺菲则将在北美、日本、亚洲和世界其他国家和地区领导商业化。
TEV-574是一款处于2b期临床试验阶段的疗法,中期数据预计到2024年下半年公布。据Transparency Market Research测算数据,2021年全球IBD市场规模就已达173亿美元,预计2030年全球IBD市场规模增长至490亿美元。
企业观察
“医药界诺贝尔奖”——盖伦奖揭晓
10月26日,2023年盖伦奖在纽约公布,由于其特殊属性,多年以来均被业界认为是“医药界的诺贝尔奖”,也是生物医学研究和创新的最高荣誉。
今年盖伦奖共7个奖项,包括:最 佳药品奖、最 佳生物技术产品奖、最 佳罕见病产品奖、最 佳医疗技术奖、最 佳数字健康产品奖、最 佳孵化器/加速器/投资者奖、最 佳初创公司奖。其中最 佳罕见病产品奖为今年新设立的奖项。
最 佳生物技术产品奖:BMS(Camzyos)FDA批准的首 款心肌肌球蛋白别构可逆性抑制剂,靶向oHCM的病理生理学;
最 佳医药产品奖:礼来(Mounjaro)近十年首 个新糖尿病药物类型;诺和诺德(司美格鲁肽)FDA自2014年以来所批准的首 款新减肥药;
最 佳孤儿药/罕见病产品奖:勃林格殷格翰(Spevigo)FDA批准的首 款GPP疗法;CSL(Hemgenix)FDA批准的首 款治疗血友病B成人患者的基因疗法;
最 佳初创公司奖:GrayMatters Health、Tessera Therapeutics、Volta Medical;
三季度财报季到来,上市药企业绩频发
截至10月31日,医药上市企业的三季度财报基本公布完毕,整体情况相较上半年有着较为明显的变化。
数据上,超过半数以上的药企营收、净利润实现正向增长,其中尤以CXO、中药与器械三个板块增长最为明显,80%的CXO公司营收正增长,中药、器械类正增长的公司也超过60%。
营收规模上,上海医药以1975.08亿的收入成为三季度最高营收企业,而非医药商业领域,白云山则既是中药领域最高营收企业,也是非医药商业药企的最高营收企业。
净利润规模上,迈瑞医药以近100亿的净利润成为医药行业中的最高水平,而智飞生物与云南白药则分别是疫苗与中药领域的最高净利润企业。
君实PD-1美国FDA获批
10月27日,美国药企CoherusBioSciences与君实生物宣布:美国FDA已经批准其特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(NPC)患者的一线治疗。其单药也获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。
“FDA批准上市的首 个中国自主研发和生产的创新生物药”等等一大堆称号,一夜间被冠以给“特瑞普利单抗”,百转千折之后,终于迎来第一个成功登陆美国市场的国产PD-1药物。这对于国内市场不断被对手挤压,甚至被PD-1后来者反超的特瑞普利单抗来说,无异于一个绝好的弯道超车契机。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030