https://www.cphi.cn 2024-01-12 11:45 来源:博药 作者:琉璃
2023年,美国食品药品监督管理局(FDA)药品评价研究中心(CDER)共批准了55种新药(38个化药和17个生物药),批准数量远高于1993年以来的历史平均水平,仅次于2018年的59种。
从治疗领域来看,抗肿瘤新药占比最多(27%),其次为罕见病、免疫系统、心血管和代谢、感染、神经系统疾病新药。
从企业来看,辉瑞、渤健、阿斯利康等跨国大药企(MNC)是新药申报的主力,但在多肽、小核酸等新分子类型中新兴生物技术公司占据重要地位,是创新的主要来源。另外,2023年有多个国产创新药成功在美国获批上市,详情见下文。
图1 美国FDA历年批准的新药数量
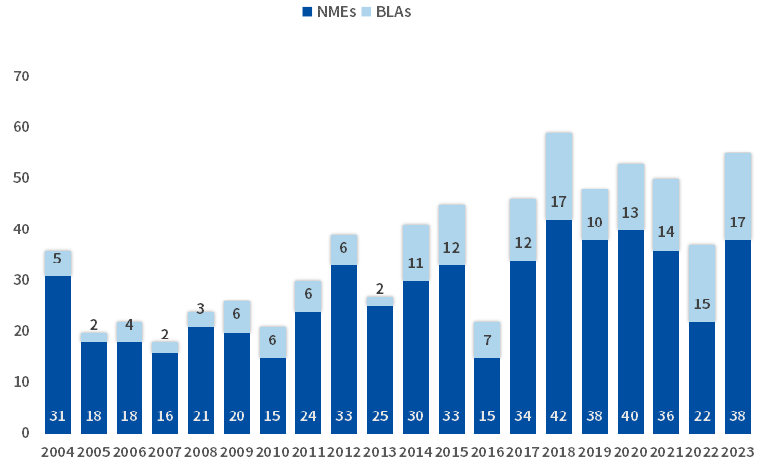
数据来源:FDA官网、博药整理
55款新药
辉瑞成最大赢家
从企业来看,全年有6 种新药获批上市,辉瑞成年度最大的赢家,包括溃疡性结肠炎新药VELSIPITY、斑秃新药LITFULO、偏头痛新药ZAVZPRET、新冠口服药物PAXLOVID、多发性骨髓瘤双抗ELREXFIO以及人生长/激素类似物NGENLA。
渤健也收获了4款新药,包括与日本卫材合作的阿尔茨海默病药物LEQEMBI、与Ionis公司合作的反义寡核苷酸疗法QALSODY、与Sage Therapeutics合作的产后抑郁症口服药ZURZUVAE以及收购Reata Pharmaceuticals所得的罕见病新药SKYCLARYS。此外,阿斯利康、UCB、GSK、安斯泰来也有多款新药获批。
值得注意的是,今年还有3款新药来自中国药企,分别为君实生物的PD-1单抗LOQTORZI(特瑞普利单抗)、和黄医药的VEGFR抑制剂FRUZAQLA(呋喹替尼)和亿帆医药的长效G-CSF产品RYZNEUTA(艾贝格司亭α注射液)。
小分子占比过半
多肽、小核酸快速发展
从药物类型来看,2023年FDA批准的新药中,NDA申请38个,占比69%,包括28个小分子新药、6个多肽和4个小核酸药物。BLA申请17个,占比31%,包括8个单抗、4个双抗、3个酶、1个融合蛋白和1个激素类药物。
小分子仍然占据新药的半壁江山,多肽和小核酸类药物为代表的新分子疗法快速发展,已成为重要的新药类型。
2023年有6个多肽类药物获批上市,占比11%,高于2022年的8%(3/37),涵盖抗肿瘤、抗感染和罕见病多个适应症。详情见(新药专题|2023年FDA批准的多肽新药)
2023年有4个小核酸药物获批上市,包括2个ASO、1个RNAi和1个核酸适配体。
与传统化药、生物药相比,小核酸药物具备:高度特异性,能靶向特定基因;不受靶点成药性限制;开发相对简单,研发成功率高;半衰期长,给药频率低;生产速度快、平台优势明显等诸多优势。截至2023年末,全球已有19款小核酸药物获批上市。
QALSODY和WAINUA为ASO疗法,起初都由Ionis公司开发。Ionis作为ASO疗法的领先者,曾在1998年就与诺华合作推出了世界上第一款获批并上市的ASO疗法Vitravene(Fomivirsen),此后Ionis又与多家企业达成合作,在不同的疾病开发ASO疗法。其中Ionis与渤健合作研发的Spinraza(nusinersen,诺西那生)商业化最为成功,于2016年12月获得美国FDA 批准上市,是治疗脊髓性肌萎缩症儿童和成人的第一个药物。自上市以来,Spinraza销售额爆发式增长,2019年全球销售额高达20.97亿美元,2020年后因为市场竞品的出现涨势有所放缓,但仍然是目前销售额最高的小核酸药物。Nusinersen于2019年在中国获批上市,并于2021年纳入国家医保目录。
QALSODY(tofersen)由渤健与Ionis 联合开发,2023年4月获FDA加速批准用于治疗具有超氧化物歧化酶1突变(SOD1)的肌萎缩侧索硬化症(ALS)。这是FDA批准的第四种治疗ALS的药物,也是第一种被批准靶向ALS遗传病因的药物。此前获批的3种药物为Relyvrio(苯丁酸钠和牛磺酸二醇)、edaravone(Radicava/Radicava ORS)、riluzole(Rilutek/Tiglutik/Exservan)。此外,还有获批用于治疗ASL相关症状的Nuedexta。ALS是一种进行性神经退行性疾病,也被称为“渐冻症”。据渤健新闻稿,具有SOD1突变的患者(SOD1-ALS)约占了2%。Qalsody是一种反义寡核苷酸药物,可以通过诱导RNase H酶介导的SOD1信使RNA降解来减少SOD1蛋白合成。为期6个月的3期临床试验结果显示,其试验虽然未达成主要终点,然而生物标志物研究显示,该药可显著降低患者体内SOD1蛋白水平,且降低了与神经轴突损伤相关的神经丝轻链(NfL)的水平。应FDA要求,渤健正在对携带SOD1突变但尚未出现症状的患者进行额外的试验,预计将于2027年产生试验结果。
WAINUA (eplontersen)由阿斯利康与Ionis联合开发,2023年12月获FDA批准用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(hATTR-PN或ATTRv-PN)。ATTRv-PN是由转甲状腺素蛋白(TTR)基因突变引起,导致产生TTR的异常版本,形成在组织中积累的毒性团块,主要在大脑和脊髓以外的神经中,造成神经损伤。Wainua是一种反义寡核苷酸-GalNAc缀合物,通过与TTR mRNA结合引起突变型和野生型TTR mRNA降解,从而减少血清TTR蛋白和组织中TTR蛋白沉积,减缓疾病的进展并改善患者的生活质量。Wainua是治疗这种疾病的第四种被批准的药物,另外3种分别是Ionis公司的Tegsedi、Alnylam公司的Amvuttra和Onpattro。但Wainua是目前全球唯一获批的用于治疗该疾病的通过自动注射器自行给药的药物。
RIVFLOZA(Nedosiran)是一款RNAi疗法,起初由Dicerna Pharmaceuticals开发,2021年11月,诺和诺德以33亿美元收购了该公司。2023年9月,FDA批准Nedosiran用于降低9岁及以上儿童和成人1型原发性高草酸尿症(PH1)患者的尿草酸水平。原发性高草酸尿症(PH)是一种罕见而严重的遗传性疾病,主要是由于编码人体丙氨酸-乙醛酸氨基转移酶(AGT)的基因发生突变,导致AGT缺失,导致患者体内草酸盐生成过多,进而引发肾结石、肾功能受损和慢性肾脏疾病等严重并发症。PH分为三种亚型,其中1型原发性高草酸尿症(PH1)最为常见,且病情最为严重。Nedosiran通过抑制特定基因的表达,以减少体内草酸盐的过度生成。这一创新疗法的批准为PH1患者带来了新的希望。
IZERVAY(Avacincaptad pegol 玻璃体注射液,简称“ACP”)是一种靶向补体C5蛋白的核酸适配体,由Iveric Bio开发,2023年4月日本制药巨头安斯泰来以 59 亿美元收购 Iveric Bio获得该疗法。2023年8月,ACP获FDA批准用于治疗由年龄相关性黄斑变性(AMD)引起的地图样萎缩(GA)。ACP是一种PEG化的抗-C5寡核苷酸药物,能抑制C5裂解成C5a和C5b。补体 C5 蛋白的过度活跃被怀疑在与年龄相关性黄斑变性 (AMD) 继发的地理萎缩 (GA) 相关的疤痕和视力丧失的发生和发展中发挥着关键作用。通过靶向 C5,ACP 有可能降低补体系统的活性,从而导致视网膜细胞变性,并可能减缓 GA 的进展。
多种“第一个”疗法
涉及多种罕见病、神经系统疾病
从适应症来看,2023年美国FDA批准的新药适应症主要集中在肿瘤、免疫系统、心血管和代谢、感染、神经系统疾病和各类罕见病,多种疾病迎来第一个疗法。
图2. 2023年CDER批准新药疾病领域分布
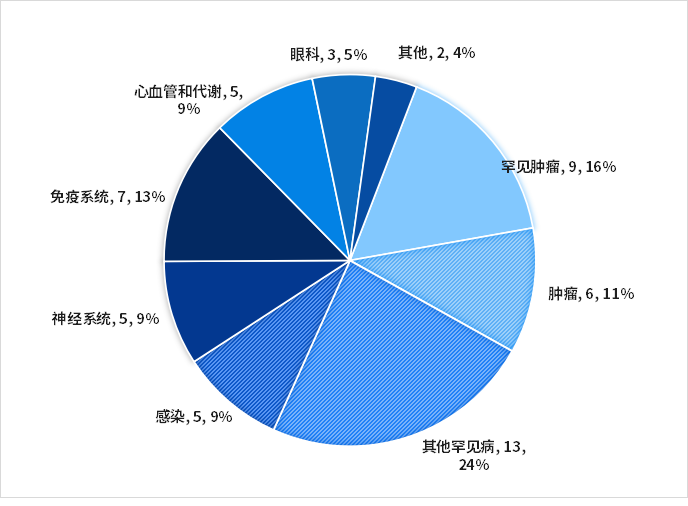
数据来源:FDA官网、博药整理
2023年共有15款抗肿瘤新药获批,但其中10款适应症为罕见肿瘤,包括默克尔细胞癌(MCC)、多发性骨髓瘤等。
此外还有十余款其他领域的罕见病新药获批(详情见表1),可见在FDA的政策鼓励下,药企对罕见病治疗药物的研发热情高涨,已成为近年来新药产出最主要的领域之一。这些突破也为罕见病患者带来治疗曙光。
下面简要介绍其中最受关注的十大第一个疗法。
1.第一个FDA完全批准的阿尔茨海默病单抗:LEQEMBI
2023年1月,FDA加速批准渤健和卫材联合开发的leqembi用于治疗阿尔茨海默病,而在2023年7月,FDA宣布在确认临床疗效后,将lecanemab转为完全批准。
Leqembi(lecanemab,仑卡奈单抗),是一款在靶向 β淀粉样蛋白的单克隆抗体,在3期临床试验中,leqembi与安慰剂组相比,平均整体临床痴呆评定量表总评分的变化降低27%。
Leqembi是第一个从加速批准转为传统批准的阿尔茨海默病单抗,意味着美国医疗保险可以覆盖该药的适应症人群,即阿尔茨海默病轻度认知障碍或轻度痴呆阶段的患者。
2022年12月leqembi已在中国提交上市申请,或许很快也将给国内阿尔茨海默病患者带来治疗新选择。
2.第一个非共价BTK抑制剂:JAYPIRCA
2023年1月,FDA批准礼来开发的BTK抑制剂Jaypirca(pirtobrutinib)用于治疗在先前治疗线(包括其他BTK抑制剂)后进展的MCL(套细胞淋巴瘤)成年患者。
虽然目前全球已有多个共价BTK抑制剂获批上市,但Jaypirca是第一个也是唯一一个获得FDA批准的非共价BTK抑制剂,它不与C481产生共价结合, 因此不会受到耐药C481突变对活性造成的抑制,有望克服共价BTK抑制剂的耐药性。
3.第一个弗里德赖希共济失调症治疗药物:SKYCLARYS
2023年2月,FDA批准Reata Pharmaceuticals开发的Skyclarys(omaveloxolone)用于治疗成人和16岁及以上青少年弗里德赖希共济失调症(Friedreich’s Ataxia,FA),这种疾病会对神经系统造成渐进性损害。
Skyclarys是一款Nrf2激动剂,这是第一种也是唯一一种适用于弗里德赖希共济失调症患者的药物。
值得一提的是,渤健在2023年7月斥资73亿美元收购了Reata Pharmaceuticals,旨在加强其神经和罕见病业务。
4.第一个Rett综合征治疗药物:DAYBUE
2023年3月,FDA批准Acadia Pharmaceuticals开发的Daybue用于治疗两岁及以上的成人和儿童Rett综合征。Rett综合征是一种罕见的进行性神经发育障碍,会导致严重的智力残疾,运动能力丧失和自闭症样症状。
Rett综合征是由位于X染色体上的MECP2基因的功能丧失突变引起的,因此,通常只有女孩患此疾病(男性患者通常在出生后不久夭折),发病率在1/10000~15000,在中国有超过50000名患者,目前尚无治愈方案。
Daybue(trofinetide,曲非奈肽)是一种新型的IGF--1氨基末端三肽的类似物,旨在通过减少神经炎症和支持突触功能来治疗Rett综合征的核心症状。
Daybue是FDA批准的第一个也是唯一一个FDA批准的Rett综合征治疗药物。
5.第一个PI3Kδ过度活化综合征靶向药物:JOENJA
2023年3月,FDA批准Pharming Group开发的Joenja (leniolisib),用于治疗12岁及以上儿童和成人患者的活化磷酸肌醇3-激酶δ(PI3Kδ)综合征(APDS)。
APDS是一种罕见的进行性原发性免疫缺陷病,Joenja是美国第一个也是唯一一个批准用于治疗PI3Kδ过度活化综合征的药物。
6.第一个治疗更年期潮热的口服非激素类NK3受体拮抗剂:VEOZAH
2023年5月,FDA批准安斯泰开发的Veozah(fezolinetant)用于治疗更年期女性的中度至重度血管舒缩症,俗称潮热。
神经激肽3(NK3)受体参与大脑调节体温的机制,veozah可通过与该受体结合以阻断其作用,直接靶向引起更年期潮热的神经活动。
Veozah是FDA批准的第一个用于治疗潮热的口服非激素类NK3受体拮抗剂,将会给数以万计的更年期女性带来福音。
7.第一个直接靶向疾病根本原因的蠕形螨治疗药物:XDEMVY
2023年7月,FDA批准Tarsus Pharmaceuticals开发的Xdemvy(lotilaner滴眼液,0.25%)用于治疗蠕形螨性睑缘炎。蠕形螨是一种非常常见的眼睑疾病,占所有睑缘炎病例的三分之二以上,主要特征是发红、发炎、睫毛缺失或错位、沿眼睑基部水平瘙痒等。
Xdemvy主要通过选择性抑制螨虫的GABA氯离子通道来根除蠕形螨的分子,是第一个美国FDA批准的直接靶向疾病根本原因的蠕形螨治疗药物。
值得一提的是,2021年LianBio(联拓生物)与 Tarsus Pharmaceuticals达成合作,获得该药在大中华区的开发和商业化独家授权,首付款1500万美元,开发和商业化里程碑付款最高可达1.85亿美元。目前该药在中国已启动III期注册临床研究。
8.第一个治疗产后抑郁症(PPD)的口服药物:ZURZUVAE
2023年8月,FDA批准Sage Therapeutics和渤健联合开发的Zurzuvae (zuranolone)用于患有产后抑郁症(PPD)的患者。产后抑郁症是一种非常严重的疾病,其特征是情绪的负面变化和功能受损。
在Zurzuvae问世之前,唯一被批准用于治疗产后抑郁症的药物是 brexanolone (商品名Zulresso),它也是由 Sage 开发的。但Zulresso需要 60 小时的静脉输液,必须在医院进行,并且存在一定风险,包括失去意识。
Zurzuvae是第一款治疗产后抑郁症的口服药物,可以在第 15 天(最快第 3 天)就快速改善抑郁症状,将会给众多患有 PPD 的女性带来福音。
9.第一个“石头人症”治疗药物:SOHONOS
2023年8月,FDA批准Ipsen(益普生)开发的Sohonos(palovarotene)上市,用于在进行性肌肉骨化症(FOP)患者中降低新骨化组织的产生。进行性肌肉骨化症的一个俗称是“石头人症”,意指随着疾病的发展,人会像石头一样无法活动。
这一罕见病的主要症状是人体中原本柔软、有弹性的肌肉和结缔组织会在轻微受伤后就出现炎症,并且会变成骨骼,将原本可以自由活动的关节锁死在一个位置上。
Sohonos是一种口服的选择性视黄酸受体γ(RARγ)激动剂,介导视黄素信号传导途径中的受体、生长因子和蛋白质之间的相互作用,以减少新的异常骨骼的形成。
10.第一个硬纤维瘤治疗药物:OGSIVEO
2023年11月,FDA批准 SpringWorks Therapeutics开发的Ogsiveo(nirogacestat)用于治疗需要全身治疗的进展性硬纤维瘤成年患者。硬纤维瘤,也称为侵袭性纤维瘤病或硬纤维瘤型纤维瘤病,是一种罕见的、通常为非恶性的软组织肿瘤。
Ogsiveo是一种口服特异性γ-分泌酶小分子抑制剂,通过阻断Notch受体的蛋白水解激活起作用。
表1. 2023年美国FDA CDER批准的55款新药
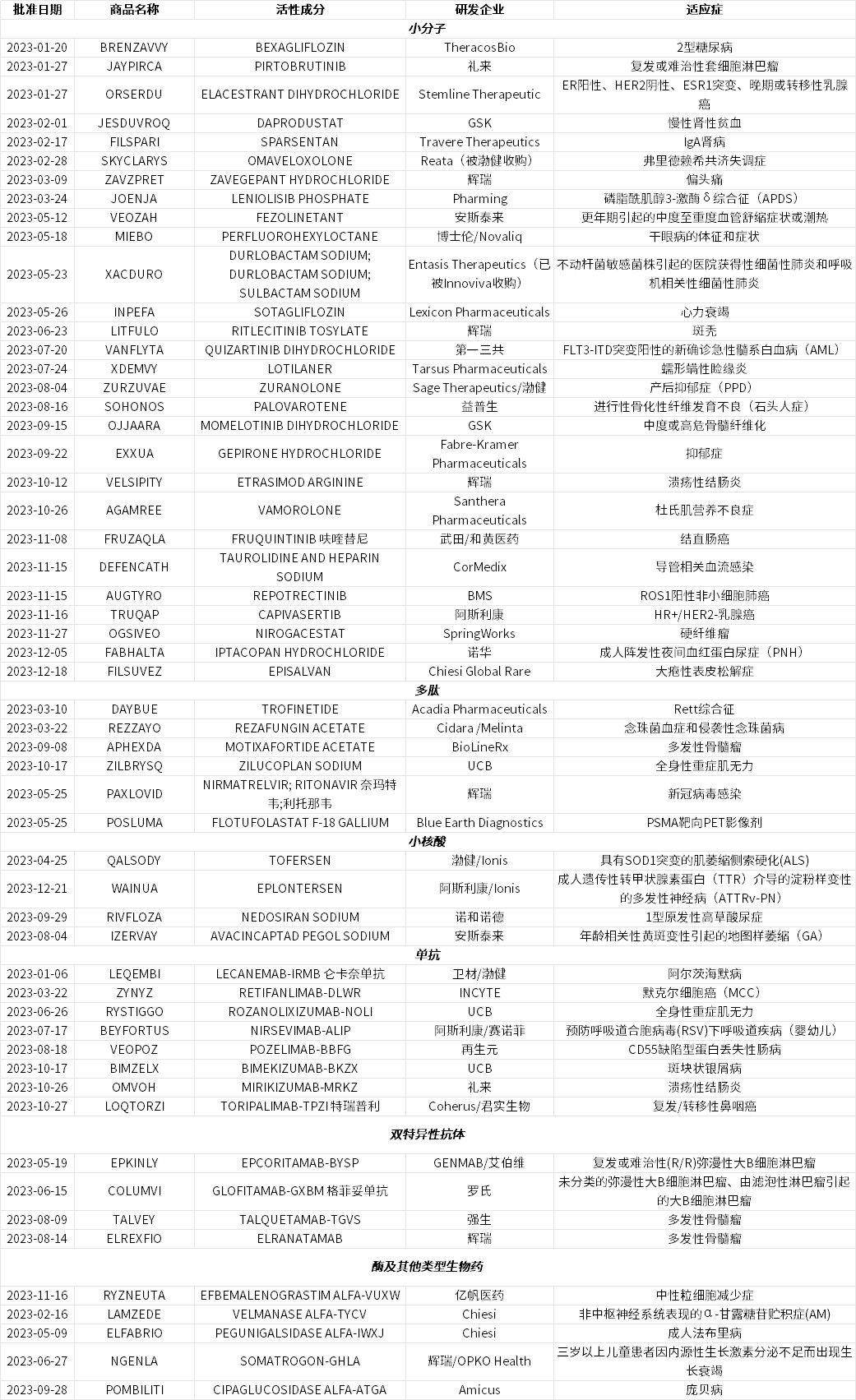
数据来源:FDA官网、博药整理
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030