https://www.cphi.cn 2024-01-16 13:26 来源:药智新闻 作者:琉璃
导读:百利天恒、百奥赛图……
过去两年全球ADC领域交易火热,海外ADC领域龙头Seagen、ImmunoGen先后被收购,第一三共大部分ADC产品与MNC达成合作,国内药企科伦博泰、百力司康、映恩生物、翰森制药、恒瑞医药、石药集团、康诺亚、宜联生物、启德医药等公司的ADC产品频繁出海。
而现在,双抗ADC成为交易的新战场。
双抗ADC,国内药企占据领先地位
相较于单抗ADC,双抗ADC具有诸多优点:既能通过双靶点增强细胞杀伤毒性,克服耐药性,又能增强肿瘤细胞特异性,减少副作用,而且双抗ADC产生新的结合和内吞动力学机制,能达到更好的治疗效果。
目前全球尚无双抗ADC获批上市,进入临床阶段的也不过十余个,其中大部分来自中国药企,仅少数几个来自国外药企(再生元的REGN5093-M114、默克的M-1231、Zymeworks的ZW-49)。
表1. 部分全球在研ADC项目
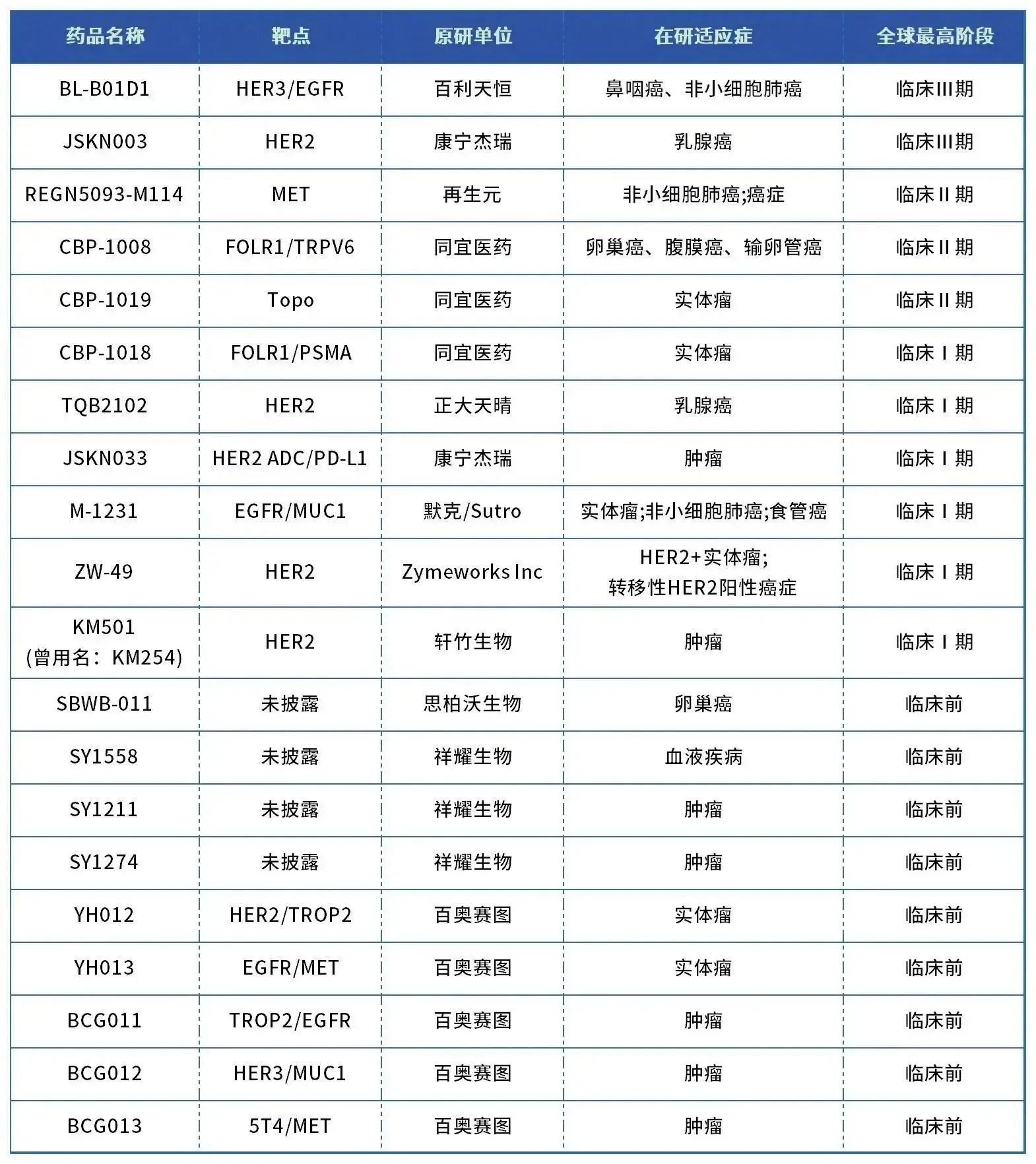
数据来源:药智数据、药智头条整理
双抗ADC领头羊:百利天恒、康宁杰瑞
目前全球有2个双抗ADC进入临床Ⅲ期,分别为百利天恒的BL-B01D1和康宁杰瑞的JSKN003。
BL-B01D1
BL-B01D1是百利天恒开发的一款HER3/EGFR双抗ADC。其抗体部分采用了自研的EGFR/HER3双抗SI-B001,对HER3亲和力低于EGFR,仅在靶向结合EGFR后才能有效结合HER3;小分子毒素部分也是自研的喜树碱衍生物Ed-04,并采用AClinker将Ed-04连接到抗体的半胱氨酸位点。这样的结构设计,让BL-B01D1的DAR值(药物抗体比)为8,不仅具有旁观者效应,在预防HER3引起的耐药性的同时,还可以针对EGFR依赖肿瘤靶向杀伤。
在2023ESMO大会上百利天恒公布了BL-B01D1治疗非小细胞肺癌患者的I期研究结果:在经过大量前线治疗的NSCLC,特别是EGFRmutNSCLC中表现出良好的疗效,观察到的毒性被认为是可接受的。
可能是看到了BL-B01D1在非小细胞肺癌的治疗潜力,12月11日,BMS与百利天恒子公司SystImmune达成合作,双方将在美国联合开发并商业化 BL-B01D1;SystImmune保留中国大陆的独家权益,而百时美施贵宝将获得在全球其他市场的独家许可。BMS将向SystImmune支付8亿美元的首付款,和最高可达5亿美元的近期或有付款;达成开发、注册和销售里程碑后,SystImmune将获得最高可达71亿美元的额外付款;潜在总交易额最高可达84亿美元。
目前BL-B01D1单药已在国内开展了5个Ia/Ib期临床研究,覆盖16种肿瘤,其中鼻咽癌适应症已处于临床Ⅲ期阶段,非小细胞肺癌适应症处于临床Ⅰ期试验。
JSKN003
JSKN003是康宁杰瑞利用特有的糖定点偶联平台开发的一款新型靶向HER2双表位ADC。据康宁杰瑞官网介绍,JSKN003相比同类药物具有更强的内吞活性和旁观者效应以及更好的血清稳定性,有效地扩大了治疗窗。在HER2高表达和低表达细胞(CDX+PDX模型)中均表现出良好的安全性特征以及与DS-8201相似的疗效。目前JSKN003正在澳大利亚和中国开展多项临床研究,针对HER2低表达乳腺癌适应症已在国内进入Ⅲ期临床阶段。
此外,康宁杰瑞将JSKN003和恩沃利单抗组成的皮下注射复方制剂JSKN033,目前正在进行一项开放、多中心、Ⅰ/Ⅱ期试验JSKN033-101。
双抗ADC最多的公司:百奥赛图
根据百奥赛图官网资料,目前百奥赛图已建立双抗ADC技术平台,并开发了几十个双抗ADC。
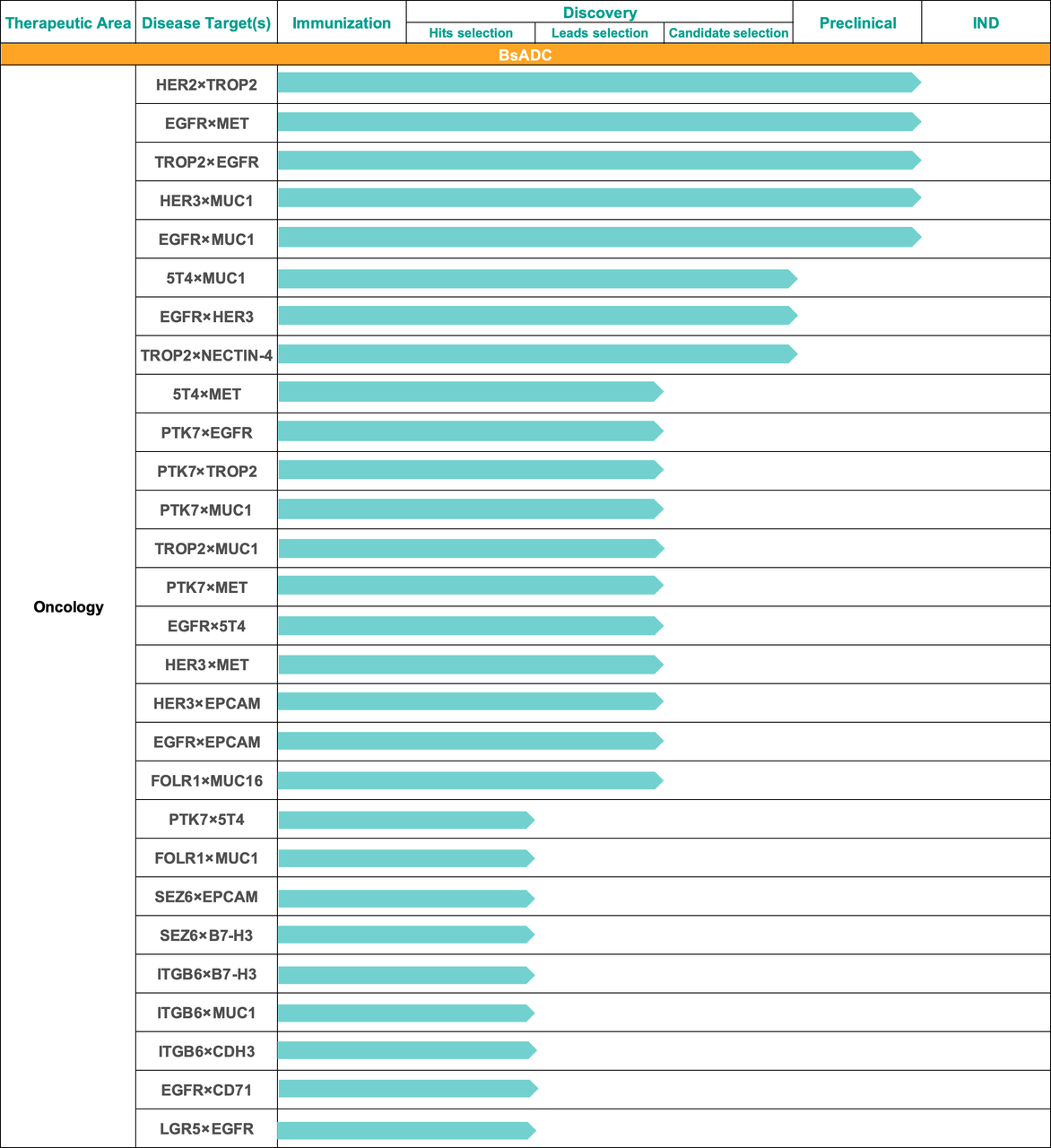
图片来源:百奥赛图官网
YH012
YH012是一款HER2 /TROP2双抗ADC。通过特异性识别肿瘤细胞、引发药物内吞来杀伤肿瘤。双抗骨架由共同轻链全人抗体鼠RenLite产生,是一种单抗结构的双抗,易于纯化和药物偶联。偶联药物为vcMMAE,DAR值为4。具有成为同类头创(first-in-class)产品的潜力。目前处于CMC阶段。
2024年1月8日,百奥赛图宣布与Radiance达成一项独家选择与授权协议。根据协议,Radiance有权选择获得一款百奥赛图同类头创全人HER2/TROP2双抗ADC的授权,用于针对任何人类疾病的治疗性产品在全球范围内的开发、生产和商业化。这次合作的项目大概率就是YH012。
在Radiance之前,思道医药此前也从百奥赛图引进了3条双抗ADC管线,均处于临床前阶段。预计于2024年1月启动IND,随后在海外和中国同步开展临床试验。思道医药拥有3条管线的知识产权和全球权益。
其他双抗ADC
ZW49
ZW49是Zymeworks公司开发的一款HER2双抗ADC,曾被认为是双抗ADC领头羊。该药物使用蛋白酶切割链接子偶联HER2双抗与ZymeLink Auristatin毒素,并可同时特异性结合HER2受体的两个非重叠表位。ZW49的母体单抗是两款已上市的抗体——pertuzumab(帕妥珠)和trastuzumab(曲妥珠),其同时靶向HER2的ECD2(帕妥珠单抗结合位点)和ECD4(曲妥珠单抗结合位点)抗原表位。
2018年11月,百济神州以4000万美元预付款、3.9亿美元里程碑金额以及销售额分成引进了ZW49、ZW25的日本、印度外亚太地区权益。然而遗憾的是,ZW49在临床试验中并未达到预期。2023年9月百济神州终止了ZW49的合作。
REGN5093-M114
REGN5093-M114是再生元研发的一款靶向MET两个不同表位的双抗ADC产品,由非对称型双特异抗体通过linker与毒素M24(美登素衍生物)连接。目前,REGN5093-M114正处于临床Ⅱ期。
M1231
M1231是Sutro和默克合作开发的一款靶向MUCI/EGFR双抗ADC。M1231采用了Sutro非天然氨基酸定点偶联技术,并通过默克的SEED双特异抗体技术平台防止两条重链的错配。其中靶向MUCI的抗体部分为scFv,而靶向EGFR的抗体部分为Fab形式,通过可裂解的Val-Cit连接子链接微管抑制剂。目前处于临床Ⅰ期。
CBP-1008/CBP-1008/CBP-1018
CBP-1008是同宜医药基于第一代bi-XDC技术平台开发了双配体偶联药物,该药由优化的特异性靶向FOLR1/TRPV6的双配体连接子系统,可酶裂解的三功能连接子,以及作为载药的细胞毒素MMAE组成。CBP-1008 I期已基本完成安全性和耐受性的探索,尚未达到MTD;II期单臂研究为既往1-3线系统抗肿瘤治疗的FRα阳性,铂耐药晚期上皮性卵巢癌、 原发性腹膜癌和输卵管癌,2023年2月已正式启动患者入组;在复发或持续性铂耐药卵巢癌、原发性腹膜癌和输卵管癌透明细胞亚型患者中的疗效和安全性的开放标签、国际多中心II期单臂研究也在同步进行中。
CBP-1018是同宜医药基于第一代bi-XDC技术平台的第二款双配偶联药物。CBP-1018分子由进一步优化的双配体系统,同时靶向FOLR1和PSMA两个受体,可酶降解的三功能连接子,以及作为载药的细胞毒素MMAE组成。CBP-1018现在正在作为单药治疗进行临床I期试验,剂量爬坡试验已顺利结束,显示出良好的安全性和耐受性,尚未达到MTD。
CBP-1019是同宜医药基于第二代bi-XDC技术平台的双配体偶联药物,通过双配体系统搭载喜树碱衍生物。在CBP-1008的基础上进一步创新和优化,对链接子进行改造,其稳定性更好,安全性更高。临床前药效学评价:在PDX肿瘤模型中,均表现出明显的抑瘤效果和剂量相关性,且安全性良好。
TQB2102
TQB2102 是正大天晴开发一种靶向 HER2 两个非重叠表位ECD2及ECD4的ADC,目前处于临床Ⅰ期。
KM501
KM501是轩竹生物通过Mebs-Ig(抗体编辑的双特异性抗体)平台开发的一款靶向HER2两个不同结构域的双抗ADC,适用于治疗HER2阳性/表达、扩增或突变的局部晚期/转移性实体瘤,包括HER2低表达的相关晚期肿瘤。该候选药物于今年3月获得中国国家药品监督管理局批准开展临床试验,目前正处于临床I期单药爬坡阶段。
小 结
理论上双抗ADC结合了双抗和ADC的优势,疗效更显著,是一条不错的赛道。
但双抗ADC的应用前景尚未验证,而且毒性问题也不容忽视。例如阿斯利康研发的双表位四价HER2 ADC药物MEDI4276,虽然对于曲妥珠单抗、帕妥珠单抗和T-DM1耐药模型都展现出了良好的疗效,但是由于出现导致停止治疗的不良事件以及剂量限制性毒性的问题,MEDI4276被终止开发。
新药研发周期长、风险高,但回报也丰厚。在双抗ADC这条赛道上,中国药企是领跑者,未来有望有更多产品获得走向国际市场的机会。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030