https://www.cphi.cn 2024-04-12 11:22 来源:药渡
Part 1
国内仿制药研发批准动态
01
新注册分类品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.03.02-03.08)无新增新注册分类首家过评受理号。与上次统计周期相比,本次减少2个新注册分类首家过评品种。
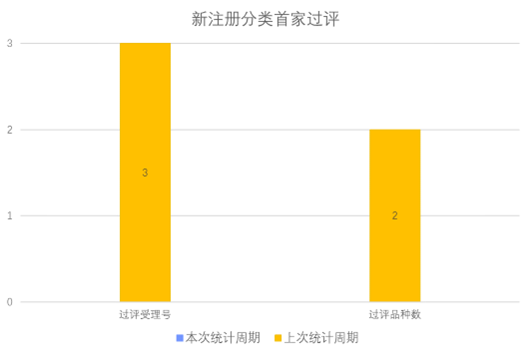
02
一致性评价品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.03.02-03.08)无新增一致性评价首家过评受理号,与上次统计周期持平。
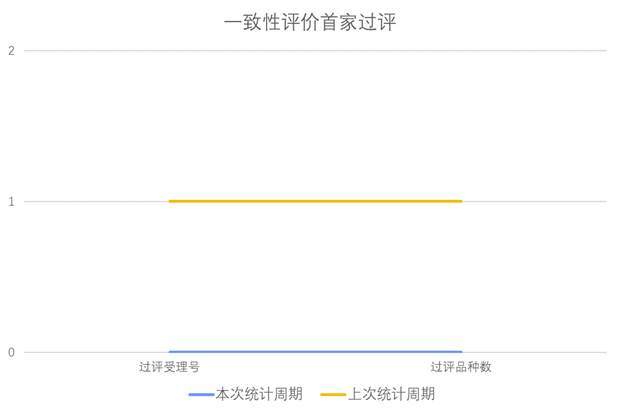
03
新注册分类品种批准上市情况
根据药渡数据调研,本次统计周期(2024.03.02-03.08)新注册分类新增4个过评受理号,涉及3个品种,包括1个片剂,2个注射剂。与上次统计周期相比,本次减少39个新注册分类过评品种。
新注册分类品种过评情况(部分)
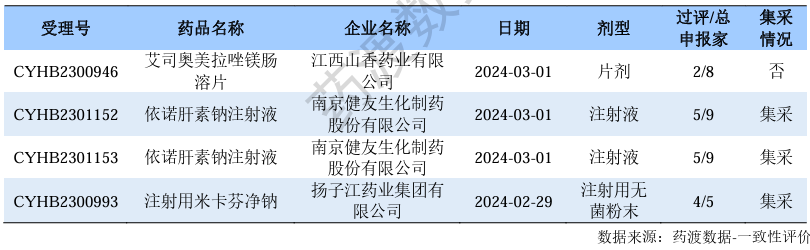
注射用米卡芬净钠
米卡芬净钠安斯泰来开发的一款1,3-β-葡聚糖合酶抑制剂和细胞壁抑制剂,也是继卡泊芬净之后全球第二个获批上市的棘白菌素类抗真菌药物。米卡芬净钠作用机制独特,副作用小,抗菌谱广,有效覆盖临床常见念珠菌以及曲霉菌,可用于血液病/恶性肿瘤患者侵袭性真菌感染的各个环节,并可应用于ICU抢救中发生的大规模真菌感染。
米卡芬净钠最早于2002年10月8日获PMDA批准在日本首 发上市;随后 2005年3月16日获FDA批准上市,2006年9月1日获NMPA批准在国内上市,2008年4月25日获EMA批准上市。根据药渡数据调研,目前米卡芬净钠已在全球绝大多数主要国家上市,上市剂型均为注射用冻干粉针剂。
药渡数据-仿制药库调研信息显示,包括原研企业安斯泰来在内,国内共有11家企业拥有注射用米卡芬净钠的生产批文。

篇幅原因,仅展示前五家企业申报进展情况,更多信息,请查看药渡数据-仿制药库
目前国内注射用米卡芬净钠的申报格局为“5+5”,药渡数据-一致性评价库统计信息显示,过评格局为“5+4”。目前只有齐鲁制药于今年1月递交的报产申请已获受理等待审评审批。

药渡数据-中国销量库统计数据显示,注射用米卡芬净钠连续多年销售情况稳步增长,2021年度销售额高达5.48亿元。2022年6月纳入集采后,全年销售额虽略有下滑,但仍然达到4.71亿元。值得一提的是,随着国产注射用米卡芬净钠陆续获批上市,销售额年年暴增,原研药市场份额被快速抢占,2020年原研企业安斯泰来的市场份额跌落六成,2022年艰难守住四成大关。米卡芬净钠是美国感染病学会(IDSA)念珠菌病临床实践指南推荐一线用药,,且在同类产品中,米卡芬净钠安全性良好,对肝肾功能不全患者及儿童、老年人无需调整剂量,并可与免疫抑制剂等多种药物联用,极少出现药物间相互作用,且价格相对低廉,市场潜力大。
04
一致性评价品种批准上市情况
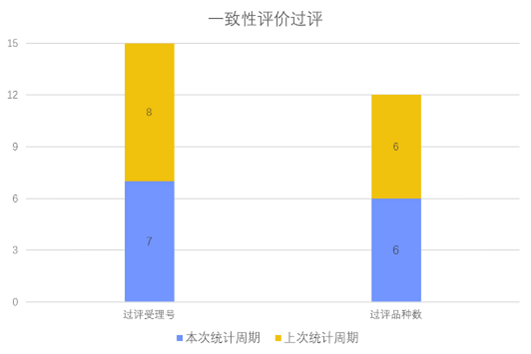
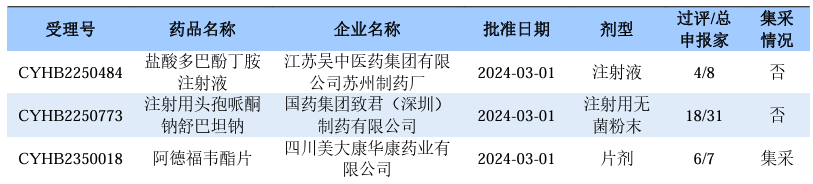
根据药渡数据调研,本次统计周期(2024.03.02-03.08)一致性评价新增7个过评受理号,涉及6个品种,包括4个注射剂,2个片剂。与上次统计周期相比,本次一致性评价过评品种与上周齐平。
一致性评价品种过评情况(部分)
05
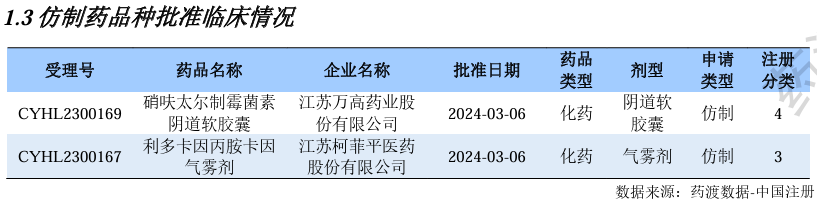
仿制药品种批准临床情况
Part 2
国内仿制药研发批准动态
01
新注册分类品种申报上市情况
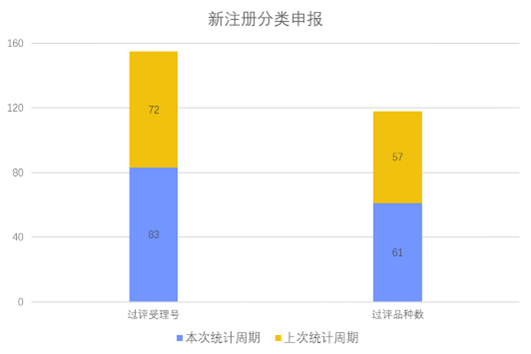
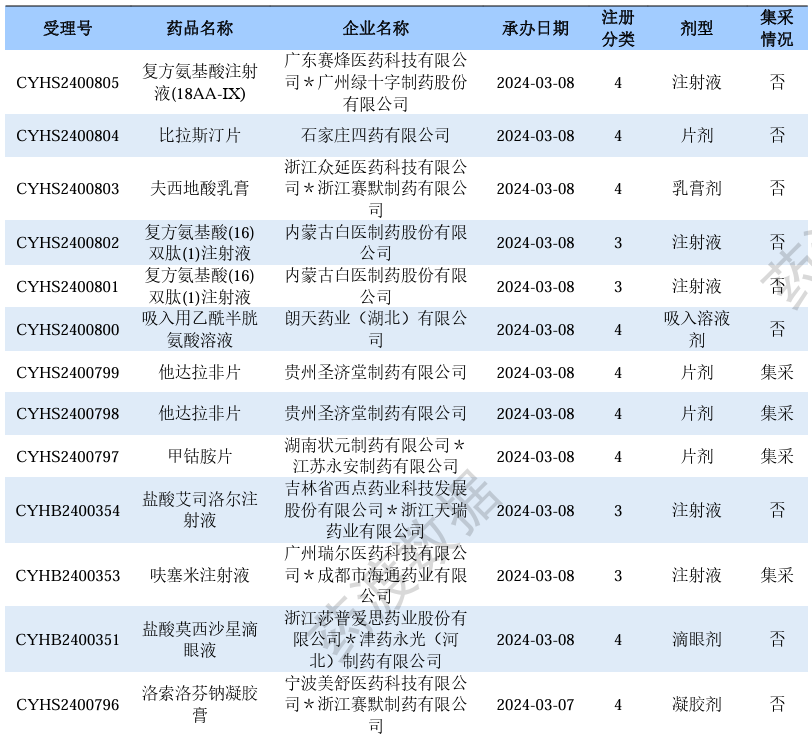
根据药渡数据调研,本次统计周期(2024.03.02-03.08)新注册分类数据新增83个新报受理号,涉及61个品种,包括4个滴眼剂,1个混悬剂,5个胶囊剂,2个颗粒剂,3个口服溶液剂,2个凝胶贴膏,20个片剂,3个乳膏剂,3个吸入溶液剂,1个直肠栓,17个注射剂。与上次统计周期相比,本次增加4个新注册分类申报品种。
新注册分类品种申报受理情况(部分)
02
一致性评价品种申报上市情况
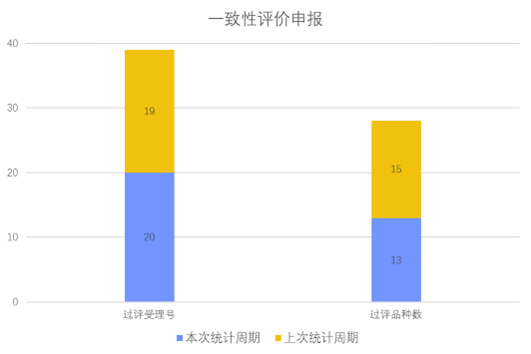
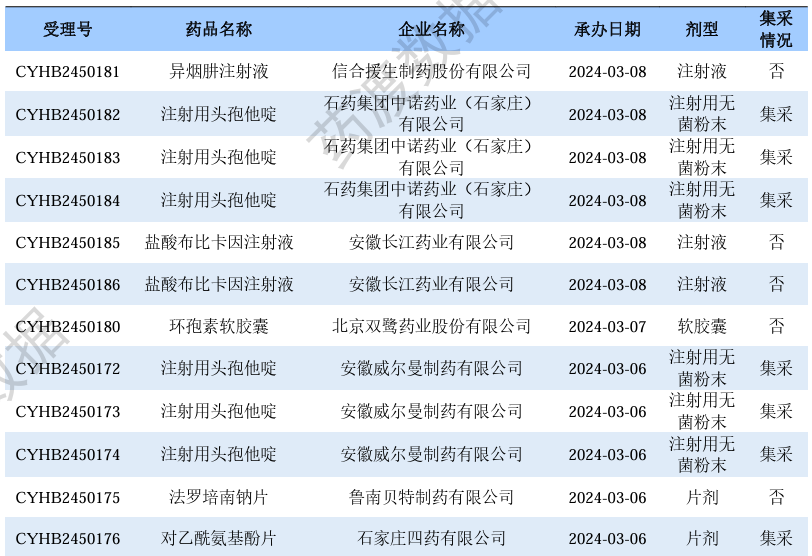
根据药渡数据调研,本次统计周期(2024.03.02-03.08)一致性评价数据新增20个新报受理号,涉及13个品种,包括1个胶囊剂,4个片剂,8个注射剂。与上次统计周期相比,本次减少2个一致性评价申报品种。
一致性评价申报受理情况(部分)
03
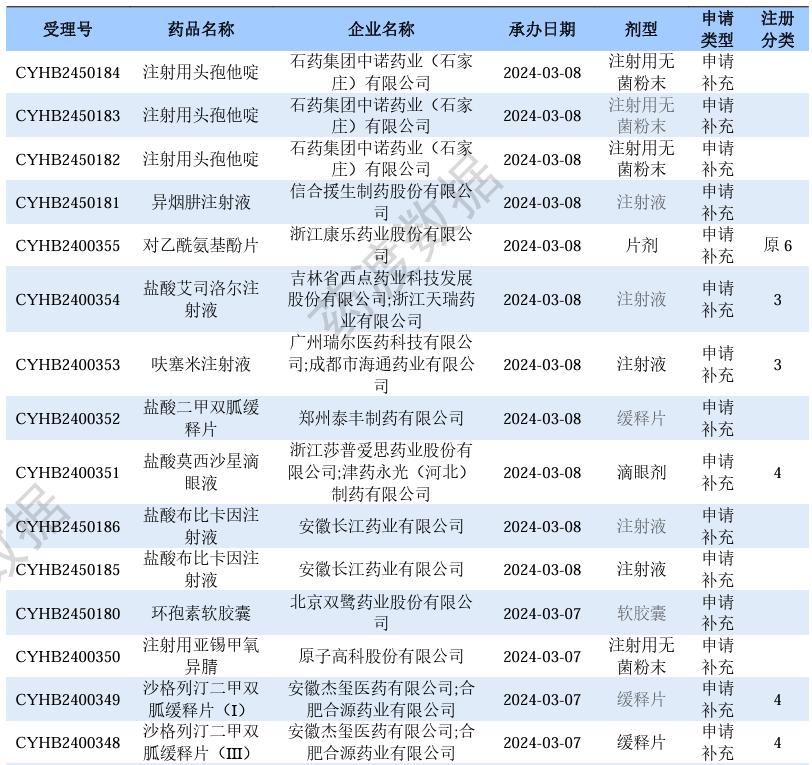
仿制药补充申请情况
04
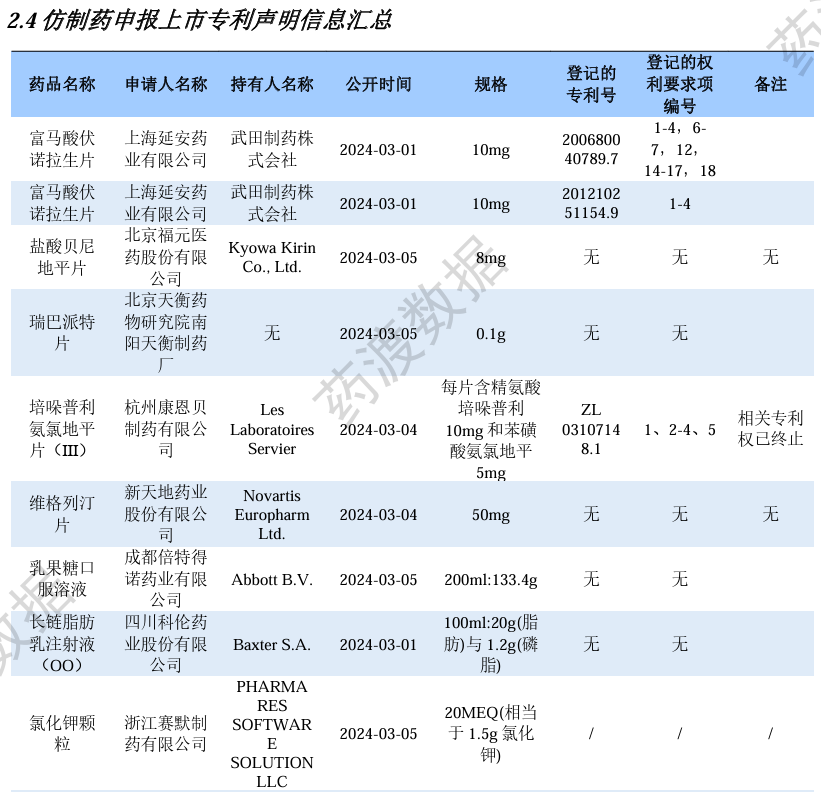
仿制药申报上市专利声明信息汇总
Part 3
国内仿制药研发领域热点聚焦
01
国内仿制药研发领域政策法规相关动态
国家药监局中药保护品种公告(第15号)(2024年第19号)
根据《中药品种保护条例》规定,国家药品监督管理局批准浙江佐力药业股份有限公司生产的灵泽片为首家中药二级保护品种,保护品种编号为:ZYB2072024002,保护期限自公告日起七年。特此公告。
02
国内仿制药研发领域热点新闻
药业:关于获得药品注册批件的公告
2024 年3月4日,深圳大佛药业股份有限公司发布公告称,公司于近日收到国家药品监督管理局核准签发的《药品注册证书》。现将相关情况公告如下:
一、药品注册证书主要内容
药品名称:盐酸多巴胺注射液
剂型 :注射剂
规格:2.5ml:50mg;5ml:100mg
注册分类:化学药品 3 类
药品批准文号:国药准字 H20243229;国药准字 H20243228
批准日期:2024 年 2 月 23 日
上市许可持有人:深圳大佛药业股份有限公司
生产企业:浙江赛默制药有限公司
二、药品基本情况
盐酸多巴胺是一类儿茶酚胺化合物, 为中枢性递质之一, 长期以来被认为是生物体内去甲肾上腺素和肾上腺素的前体,具有升高血、兴奋β-受体、α-受体和多巴胺受体的作用,兴奋心脏β-受体可增加心肌收缩力,增加心输出量。
临床上用于心肌梗死、创伤、内毒素败血症、心脏手术、肾功能衰竭、充血性心力衰竭等引起的休克综合征。
三、 对公司的影响及风险提示
公司获得盐酸多巴胺注射液药品注册证书,进一步丰富了公司专科药产品线,提升公司市场竞争力,对公司的经营发展具有积极作用。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030