https://www.cphi.cn 2018-11-30 09:48 来源:CPhI制药在线 作者:惟医
肝细胞癌是肝 脏中最常见的原发性恶性肿瘤,慢性病毒感染(乙型肝炎或丙型肝炎)或酒精性肝硬化为主要的潜在危险因素。大多数患者在早期或中期被诊断出,可采用手术治疗、局部消融、栓塞动脉定向治疗等,但复发率高。肝癌已成为美国癌症中致死率较高的肿瘤之一,晚期主要采用全身姑息治疗。
现有治疗方式
目前,已批准三种口服多激酶抑制剂(MKIs)用于全身治疗,其中两种作为一线治疗。自2007年以来,索拉非尼(Nexavar; Bayer)一直被用作晚期肝细胞癌的一线用药,用于肝功能和表现良好的患者,是第一个与安慰剂相比总生存期(OS)获益的靶向药物。但客观反应率(ORR)较安慰剂组低(2%)。
2017年4月,多靶点激酶抑制剂-瑞格非尼(Stivarga; Bayer,图1)获FDA批准用于索拉非尼治疗无效的肝癌患者。值得注意的是,瑞格非尼会导致肝**的发生或剂量中断、减少。
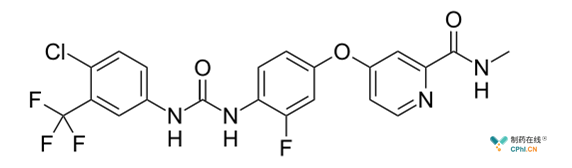
图1 瑞格非尼分子结构式
另一种多靶点激酶抑制剂,lenvatinib(Lenvima; Eisai和Merck&Co.,图2)2018年3月和2018年8月分别在日本,美国和欧洲被批准作为无法切除的肝细胞癌的一线疗法,本次批准是基于一项 III 期临床研究 REFLECT(Study 304)的数据,与 sorafenib 相比,lenvatinib 在 OS 方面达到了非劣效性的统计学标准。
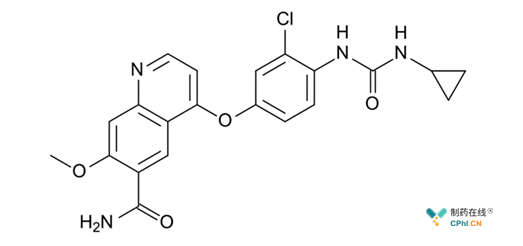
图2 lenvatinib分子结构式
程序性细胞死亡蛋白1(PD1)抑制剂nivolumab(Opdivo; Bristol-Myers Squibb / Ono Pharmaceutical)是唯一被批准用于肝细胞癌的生物制剂。基于I / II期(CheckMate-040)试验的ORR和耐药性结果,2017年9月获得了FDA对索拉非尼治疗复发患者的加速批准。
尽管数据喜人,但2017年7月Bristol-Myers Squibb撤销了纳武单抗(nivolumab)在欧洲用于索拉非尼治疗后复发的肝癌申请,这是由于欧洲药品管理局(EMA)人用医疗产品委员会(CHMP)认为CheckMate-040非对照试验的不确定性。公司对CheckMate-040进行改进(CheckMate-459),纳武单抗在III期(CheckMate-459)试验中已被评估为索拉非尼治疗后的一线治疗用药,也是III期(CheckMate-9DX)中唯一的切除或消融辅助治疗后的靶向药物。
重要在研管线
血管生成抑制剂和免疫检查点抑制剂是主要的肝癌在研药物方向,联合用药也在开发中(图3)。
口服MKI抑制剂cabozantinib(Cabometyx; Exelixis / Ipsen / Takeda)在复发的晚期肝细胞癌(III期; CELESTIAL)中其主要终点(OS)与安慰剂相似。与仅服用索拉非尼相比,cabozantinib可改善OS。对比cabozantinib的3级或4级不良反应,如停药率和ORR(4%)与其他已批准用于肝细胞癌治疗的MKI抑制剂相当。Cabozantinib正在美国和欧洲进行监管审查,同时FDA已将PDUFA日期定为2019年1月14日。
Ramucirumab(Cyramza; Eli Lilly)是一种靶向血管内皮生长因子受体2(VEGFR2)单克隆抗体(mAb),在临床Ⅲ(REACH-2)试验中达到主要终点OS。与瑞格菲尼和cabozantinib一样,Ramucirumab(联合支持治疗(BSC))在索拉非尼治疗后的患者中能够改善OS。然而,不同于相同条件的其他试验,参与者的甲胎蛋白(AFP)水平较高。Ⅲ期预先指定的亚组分析REACH试验中,REACH-2触发,但在未选择的患者中Ramucirumab未能显著改善OS。通常约有二分之一的晚期肝细胞癌患者AFP含量偏高。Ramucirumab用于该生物标志物人群试验结果将在2018年提交监管资料。
PD1抑制剂Pembrolizumab(Keytruda; Merck&Co)正在开展索拉非尼治疗复发的晚期肝癌患者临床试验(III期; KEYNOTE-240)。2018年7月,Pembrolizumab获得了FDA的复发晚期肝癌的优先审查资格。基于II期数据,默克正在寻求加速审批,同时FDA的PDUFA目标审查日期定于2018年11月9日。
其他在研的肝癌PD1抑制剂的包括tislelizumab(BeiGene / Celgene)和spartalizumab(Novartis Oncology)等。Tislelizumab正在开展先前治疗和未治疗但已局部晚期或转移的患者试验。Spartalizumab正在作为单一疗法,或与c-MET(也称为HGFR)抑制剂Capmatinib(Novartis Oncology)联合用药用于晚期肝癌治疗。
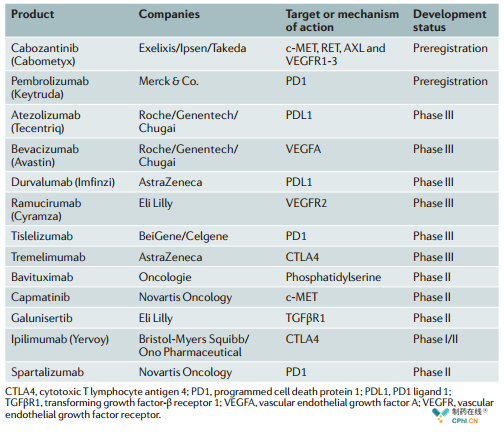
图3 肝癌重要的在研管线
包括tislelizumab在内的多项靶向药物正在针对先前未接受治疗的患者,开展与索拉非尼进行头对头评估III期试验,许多MKI未能显著改善OS。与ramucirumab一样,bevacizumab(Avastin; Roche / Genentech / Chugai)一种mAb血管生成抑制剂,靶向VEGF配体。Atezolizumab(Tecentriq; Roche / Genentech / Chugai)与PD1配体1(PDL1)抑制剂联合用药,针对未接受过任何系统治疗的局部晚期或转移性肝细胞癌患者,正在开展IMbrave150试验;根据Ib期数据,2018年7月FDA批准atezolizumab与bevacizumab联合用药作为突破性疗法用于晚期或转移性疾病的一线疗法。
PDL1抑制剂durvalumab(Imfinzi; AstraZeneca)正在开展一项针对不可切除的晚期或转移性肝癌的HIMALAYA试验。其他正在进行的联合治疗有转化生长因子-β受体1(TGFβR1)抑制剂galunisertib(Eli Lilly),联合nivolumab、ramucirumab、索拉非尼和转化的磷脂酰丝氨酸靶向mAb bavituximab(Oncologie)。与ramucirumab一样,galunisertib也作为单药治疗,用于索拉非尼治疗复发或索拉非尼不佳的高AFP水平患者。
市场预测
肝癌药物市场规模预计将从8.7亿美元(2017年)上升到近40亿美元(2027年)。市场增长将受益于其他8种高价生物制剂上市以及nivolumab作为一线疗法的广泛推广。
2027年,预计PDL1抑制剂将成为市场占比种类,销售额将达17亿美元(图4),并超过PD1抑制剂。其中近50%销售额贡献来自既单药治疗,或与tremelimumab联合用药作为晚期患者的一线治疗,另外其用于中期患者也将贡献3.2亿美元收入。Atezolizumab(与贝伐单抗合用)预计仅作为一线治疗2027年销售额达5.3亿美元。
预计2027年PD1抑制剂的销售额将近15亿美元,其中nivolumab达11亿美元,占整个2027市场的25%以上。尽管一线药物的患者群体,但预计nivolumab在非一线治疗中的销售额约占其总销售额的50%。
预计CTLA4抑制剂ipilimumab和tremelimumab的销售额(合计3.2亿美元)远低于PDL1或PD1抑制剂。两种药物销售额与nivolumab或durvalumab的联合用药相关。虽然联合疗法比单一药物更有效,但用药将受限于安全性和耐受性。
血管生成抑制剂在2017年市场份额领先。尽管也将有更多的生物和小分子血管生成抑制剂得到批准,但销售额将在2019年达到峰值,随后将逐渐下降,预计该类药物仿制药将影响未来的销售潜力。
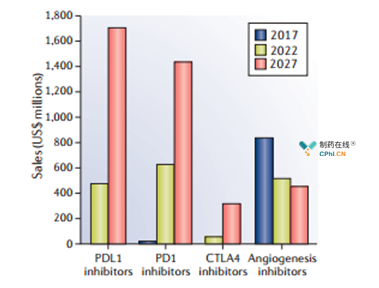
图4 主要免疫抑制剂的市场预测
作者简介:惟医,医药行业从业者,关注医药政策、企业和产品动态,把握趋势,发现价值。擅长药物递送项目评估,已发表多篇相关文章。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030