https://www.cphi.cn 2023-12-05 18:15 来源:CPHI制药在线 作者:今夏
【案例描述】
质量负责人在成品放行审核时,发现某产品生产批号打歪了。为何审核记录就能发现批号歪了呢?因为这个企业生产记录中的外包工序:附有已打印生产批号、生产日期、有效期至的样稿。然后呢,质量负责人就去成品库查验已入库的产品,发现生产批号打歪的还不在少数。如图所示:
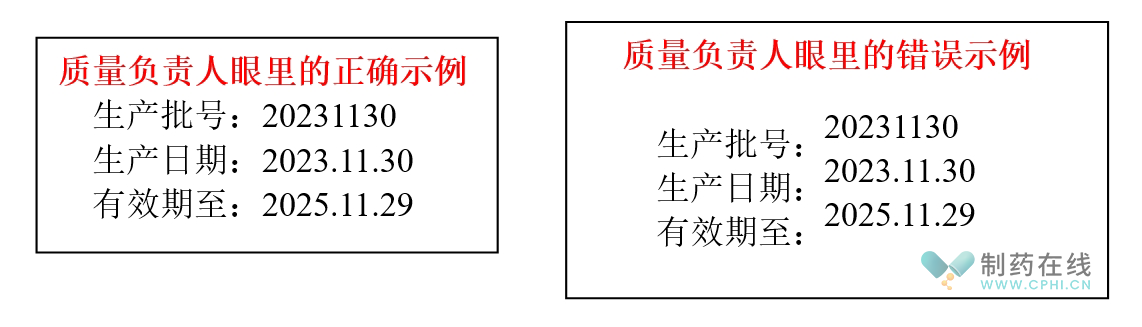
这下事可大了,质量负责人也不签字了,也不放行了。生产、销售、库房几个部门是各种协调,说批号打歪了,不影响产品质量,而且别人家的同类产品也有打歪的情况,没问题呀。
可是呢,无论你怎么解释,质量负责人就一句话:质量部有"一票否决权",我说不放就不放。
看到这里,不知道各位读者,作何感想?如果你是质量负责人,你会怎么做?笔者曾经就职于一家咨询公司,各色各样的质量负责人也见了不少,喜欢高唱"一票否决权"的质量负责人多数来源于药厂并且做过质量体系(尤其是跳槽到小企业后)。
为此呢,笔者查阅了很多药品类的法规,也认真研发研读了药品的6本GMP,这么多资料,关于质量部的描写均是:质量部应独立行使职能。所以,独立行使职能是否等于一票否决呢?
笔者对《药品生产质量管理规范及其13个附录》进行"放行""否决"关键词检索,其中:
关于"放行"共计86个结果,明确指明质量受权人的是:第9条、第23条、第25条、第230条、第288条。虽然用词不同,但本质一样,均是:确保在产品放行前完成对批记录的审核、每批产品经质量受权人批准后方可放行、均应由质量受权人签名批准放行。其他关于"放行"的要求均是以"质量管理部"为第一人称的,比如出现不规范操作后,要求整改到位后,才可放行,这个整改是全员参与,不是质量负责人一个人。
关于"否决"共计1个结果,第255条:质量管理部门应当对所有生产用物料的供应商进行质量评估,会同有关部门对主要物料供应商(尤其是生产商)的质量体系进行现场质量审计,并对质量评估不符合要求的供应商行使否决权(企业法定代表人、企业负责人及其他部门的人员不得干扰或妨碍质量管理部门对物料供应商独立作出质量评估)。
看到这里,大家还觉得独立行使职能跟一票否决是一回事吗?独立行使职能是基于专业、技术、经验等等一些手段,来掌握产品生产过程和质量控制的所有关键信息。而这个掌握不是靠单审核记录能看出来的。有人说:"如果通过合格的记录,不能发现过程隐患,那一定是记录表单设计得不合理"。这句话,对吗?好像对,可实际运用又好像没那么合理,不合理在哪呢,通过记录确实可以发现一些问题,但再详尽的记录,也控制不了主观意识。
真正的放行是各部门协作,是承担起相应的职责,将可靠的过程控制、偏差调查及评价、变更影响评估等信息传递给放行决策者,从而保证放行决策者正确地开展放行决策。所以,质量受权人、质量管理部门、生产部门和采购部门都是物料和产品放行职责的主要承担者。
回到案例,质量负责人与生产部门都有不足的地方:
①质量负责人简单的把自己定义成监督者,合格不合格,影响不影响产品的安全有效,全凭感觉,而不是专业。正如前文提到的主观意识,极其不负责任。法规从来没有要求质量负责人凭感觉做决策。即使有偏差,也是要求调查、整改、评估,结果不影响产品的安全性、有效性时,才可放行,而不是让你凭感觉一票否决。
②生产部门呢,也没有在批记录中对批号打歪这件事进行偏差调查及评价。
这时,肯定有人又问了,如果连批号打歪这件事,都要走手续,那体系岂不是越来越复杂?所以,这就是你的风险分析了,你在分析产品风险点的时候,就没想过设备可能出问题?人员可能出问题吗?打码环节可能发生什么吗?每一种可能发生的风险,你没有评估吗?哪种风险是可接受的?哪种是需要调查的?哪种是不可接受的?哪种是必须报废的?不得返工的?等等。。。
所以最后,笔者想说,真正的质量管理部不是监督,更不是你以为的人上人,是通过专业,让每一个人都自发地执行体系,真正实现全员参与和全员质量意识。
作者简介:今夏,多年从事医药质量法规和生产现场监督指导工作,指导大量企业成功完成多款产品的注册申报和体系考核,具有扎实的质量法规理论知识和丰富的实战经验。熟悉《GB/T 19001-2016/ISO 9001:2015质量管理体系 要求》等QMS系列标准。期间通过了执业药师考试、聘任了中级工程师。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030