https://www.cphi.cn 2024-04-12 13:22 来源:药智头条 作者:在水
2023 年是细胞和基因疗法(CGT)大放异彩的一年,美国FDA共批准了 7 款疗法。
2024年第一季度,全球CGT疗法的获批速度持续。据药智头条统计,2024年Q1全球范围内共有4款CGT疗法获批上市,细胞疗法有3款,基因疗法1款。
表1:2024 Q1 获批上市的CGT疗法
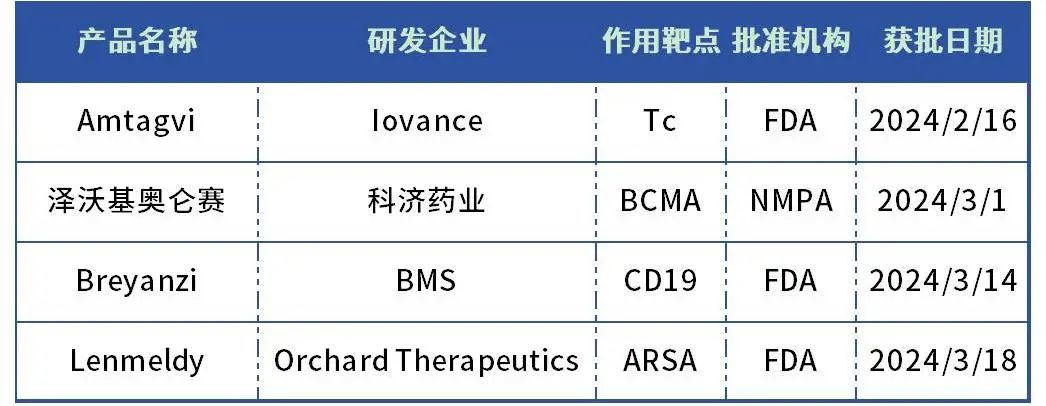
数据来源:根据药智数据、公开资料整理
细胞疗法:3款
国内获批第五款CAR-T疗法
1. Amtagvi
研发企业:Iovance
获批时间:2024年2月16日
批准机构:FDA
获批适应症:黑色素瘤
Amtagvi是Iovance Biotherapeutics 公司研发的一种一次性细胞疗法,于2024年2月16日通过FDA加速审批途径批准用于治疗不可切除或转移性黑色素瘤,成为全球首 款肿瘤浸润淋巴细胞(TIL)疗法。
部分专家认为Amtagvi比CAR-T疗法更有优势。Turnstone Biologics公司首席执行官Sammy Farah在接受BioSpace媒体的采访中表示,CAR-T只能识别肿瘤细胞表面的少量蛋白质,而TIL则能识别来自细胞内或细胞外肿瘤蛋白质的肿瘤靶点。
据Iovance新闻稿,目前Amtagvi的定价为51.5万美元。
2. 泽沃基奥仑赛
研发企业:科济药业
获批时间:2024年3月1日
批准机构:NMPA
获批适应症:复发或难治性多发性骨髓瘤
2024年3月1日,科济药业宣布其自研新药靶向BCMA的CAR-T细胞疗法泽沃基奥仑赛注射液已在中国获批上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
泽沃基奥仑赛是国内第五款获批的CAR-T疗法,再次证明了中国细胞疗法进入快速发展期。
但CAR-T细胞疗法的商业化一直被认为是行业难题。泽沃基奥仑赛定价115万/针,略低于伊基奥仑赛。目前国内上市的五款CAR-T细胞疗法中,仅有一款定价没有打破百万元门槛,但也需99.9万元一支,超出大部分患者的支付能力。
表2:国内已上市的CAR-T细胞疗法
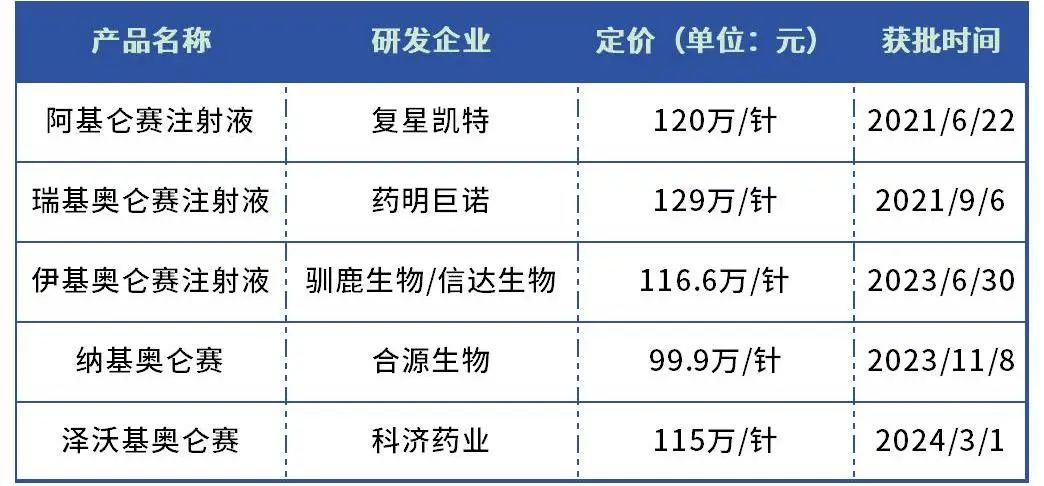
数据来源:药智数据
不过,科济药业曾在媒体采访中表示,其也正在CAR-T的创新支付模式上做一些努力,积极帮助患者获得惠民保和商业保险的支持。
3. Breyanzi
研发企业:BMS
获批时间:2024年3月14日
批准机构:FDA
获批适应症:慢性淋巴细胞白血病和小淋巴细胞白血病
Breyanzi是由百时美施贵宝旗下公司 Juno Therapeutics研发的一种靶向CD19抗原的CAR-T细胞疗法,具有明确的组成和4-1BB共刺激域。3月14日获得FDA批准,成为全球首 个 治疗复发或难治性慢性淋巴细胞白血病(CLL)和小淋巴细胞白血病的CAR-T细胞疗法,同时也是全球范围内第四款获批上市的 CAR-T 疗法药物。
Breyanzi的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用。4-1BB信号结构域则增强了CAR-T细胞的扩增和持久性。
此次获批基于的TRANSCEND CLL 004试验是一项开放标签、单臂、多中心的临床1/2期试验。数据分析显示试验达成主要终点,20%接受Breyanzi治疗的复发或难治性CLL或SLL患者患者达到完全缓解(CR),缓解持续时间超过 35 个月,且安全性已确认。
此前,Breyanzi已分别在美国、欧盟和日本获批用于治疗弥漫性大B细胞淋巴瘤 (DLBCL),上市价格为41.03万美元。根据BMS披露的2023年财报,Breyanzi实现了3.64亿美元的销售额,同比翻倍。
如今,Breyanzi攻下CLL/SLL新适应症,且成为目前该适应症中唯一获批的CAR-T细胞疗法,加之进行差异化拓展后,竞争力将得到再度提升,Breyanzi 在2024年的商业化表现有望更进一竿。
基因疗法:1款
定价425万美元
Lenmeldy
研发企业:Orchard Therapeutics
获批时间:2024年3月18日
获批机构:FDA
获批适应症:异染性脑白质营养不良
2024年3月18日,FDA宣布批准由Orchard Therapeutics开发的基因疗法Lenmeldy(atidarsagene autotemcel,arsa-cel),用于治疗满足特定条件的异染性脑白质营养不良(MLD)儿童患者。此次获批,标志着Lenmeldy成为FDA批准的首 个 针对MLD的基因疗法。
MLD是一种罕见的致命性遗传性疾病,由ARSA基因(22q13.33)突变引起芳基硫酸酯酶A缺乏从而无法正常代谢硫苷脂,从而造成中枢和周围神经系统损害。患儿最终会恶化为植物人状态,可能需要24h重症监护,大多数患者在发病五年内去世,给家庭带来巨大的经济负担。
Lenmeldy旨在通过将一个或多个功能性人类ARSA基因的副本在体外(体外)插入患者自身造血干细胞(HSCs)的基因组中,使用慢病毒载体来纠正MLD的潜在遗传原因。修复的基因细胞被输回患者体内,一旦植入,它们会分化成多种细胞类型,其中一些会越过血脑屏障进入中枢神经系统并表达功能性酶。这种方法有望通过一次治疗恢复酶功能以停止或减缓疾病进展。
2024年3月20日,Orchard Therapeutics公司官网发布公告披露了Lenmeldy在美国商业化上市的相关细节,将该药的价格定为425万美元。尽管Orchard 认为425万美元定价合理,但该价格刷新了天价药记录,在此之前,全球最贵药物为CSL Behring和uniQure开发的Hemgenix,定价350万美元。
更多CGT疗法在路上
CGT疗法正在逐渐成为生物医药领域的黄金赛道,更多潜力等待被发掘。除2024年第一季度获批的4款药物外,据不完全统计,2024年还有8款CGT疗法有望成功闯关FDA,其中Rocket Pharmaceuticals旗下的Kresladi和辉瑞旗下的Beqvez更是领先一步,将在上半年拿到通行证。
表3:2024年有望获批的CGT疗法
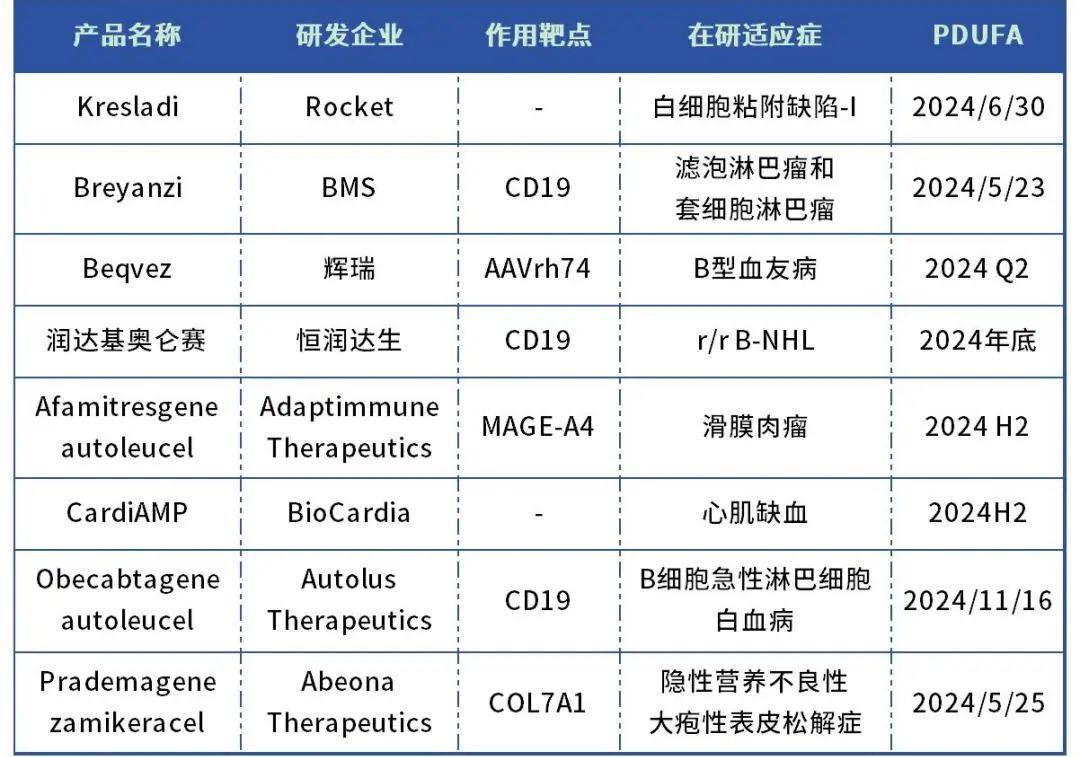
数据来源:根据药智数据、公开资料整理
1. Kresladi
研发企业:Rocket
在研适应症:白细胞粘附缺陷-I
PDUFA日期:2024年6 月 30 日
FDA延长了Rocket Pharmaceuticals基因疗法Kresladi?(RP-L201,marnetegragene autotemcel)用于治疗严重白细胞粘附缺陷-I(LAD-I)的生物制品许可申请(BLA)的优先审查期,PDUFA日期由今年3月31日延长至6月30日。FDA尚无召开咨询委员会会议的计划,延期或与FDA自身人员配置问题有关。
2. Breyanzi
研发企业:BMS
在研适应症:滤泡淋巴瘤和套细胞淋巴瘤
PDUFA日期:2024年5月23日
2024年对于Breyanzi 而言可谓是收获之年。BMS预计 FDA 将于 5 月 23 日就Breyanzi治疗复发或难治性滤泡性淋巴瘤患者做出决定,并于 5 月 31 日就Breyanzi治疗接受过布鲁顿酪氨酸激酶抑制剂治疗的复发或难治性套细胞淋巴瘤患者做出决定。
3. Beqvez
研发企业:辉瑞
在研适应症:B型血友病
PDUFA日期:2024 年第二季度
Beqvez(通用名:fidanacogene elaparvovec)是一款用于基于AAVrh74的腺相关病毒(AAV)基因治疗药物。
2024年1 月3日,辉瑞宣布,加拿大卫生部批准Beqvez上市,用于治疗18岁或以上中重度至重度乙型血友病成人患者,这些患者体内需确认不带有靶向腺相关病毒(AAV)血清型 Rh74 亚型的中和抗体。
目前Beqvez基因疗法尚未在美国获批上市, FDA于2023年6月接受了辉瑞的生物制品许可申请,预计将于2024年第二季度做出审批决定。
4. 润达基奥仑赛注射液
研发企业:恒润达生
在研适应症:复发/难治性B细胞非霍奇金淋巴瘤
拟获批时间:2024年底
2023年12月14日,CDE官网公示,恒润达生的润达基奥仑赛注射液(拟定)申报上市获受理。据恒润达生早前招股书资料显示,该药靶点为CD19,其临床试验申请适应症为复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL),值得一提,此前该药已被纳入优先审评,有望在2024年底或2025年获批。
小 结
CGT疗法是迅速兴起的新式治疗手段,具有“一次治疗,永 久治愈”的潜力,然而高昂的定价也是使其备受市场诟病的地方。伴随着全球药企治疗技术的深入研究,相信未来在各方努力下,CGT疗法一定会突破更多瓶颈,将价格打下来,真正造福更多癌症患者。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030