https://www.cphi.cn 2023-03-01 11:05 来源:深圳证券交易所
深圳证券交易所:
中信证券股份有限公司(以下简称“中信证券”或“本保荐机构”)作为西藏多瑞医药股份有限公司(以下简称“多瑞医药”、“公司”或“上市公司”)首次公开发行人民币 A 股并在创业板上市的保荐机构,针对贵部下发的《关于对西藏多瑞医药股份有限公司的关注函》(创业板关注函〔2023〕第 81 号)的相关问题进行回复并出具核查意见如下:
问题一:
结合项目规划进度与实际执行进度的差异情况,说明“新产品开发项目”和“年产 1600 万袋醋酸钠林格注射液(三期)项目”募投项目进展缓慢的具体原因,是否存在影响项目可行性的实质性障碍,历次募集资金使用专项报告是否披露了募投项目实际投资进度与投资计划存在差异的具体原因。请你公司作出补充说明。
请保荐机构发表核查意见。
回复:
一、公司说明
(一)结合项目规划进度与实际执行进度的差异情况,说明“新产品开发项目”和“年产 1600 万袋醋酸钠林格注射液(三期)项目”募投项目进展缓慢的具体原因,是否存在影响项目可行性的实质性障碍。
1、“新产品开发项目”规划进度与实际执行进度的差异情况及进展缓慢的具体原因
1)“新产品开发项目”中各个子项目规划进度与实际执行进度的差异情况公司于 2021 年 9 月 29 日在深圳证券交易所上市。截至目前,“新产品开发项目”中各个子项目规划进度、实际执行进度具体情况如下:
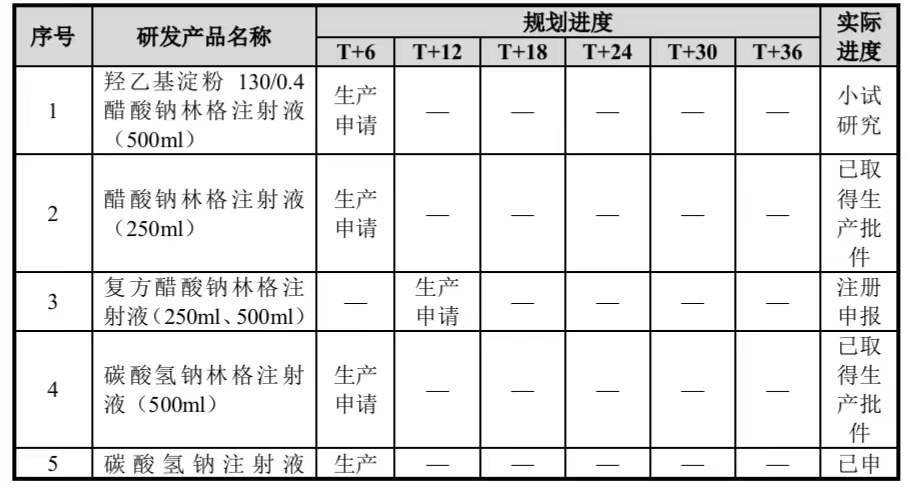
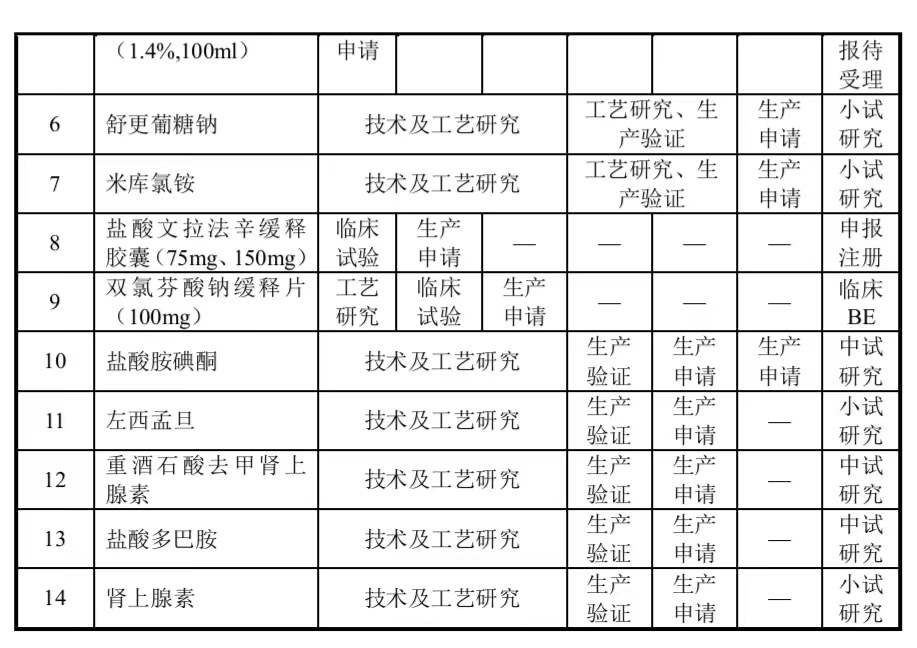
“新产品开发项目”中除羟乙基淀粉 130/0.4 醋酸钠林格注射液(500ml)、双氯芬酸钠缓释片(100mg)2 个子项目进度略有滞后,其他子项目基本上按照规划进度推进。
2)募投项目“新产品开发项目”进展缓慢的具体原因
总体上看,“新产品开发项目”的实际进度与规划进度不存在较大差异。截至 2023 年 1 月末该募投项目使用自有资金和募集资金投入金额分别为 1,903.47万元、0.00 万元,募集资金使用进度缓慢主要原因为:上述新产品开发项目备案主体和实施主体为多瑞医药,公司原计划将部分研发项目从子公司湖北多瑞药业有限公司(以下简称“湖北多瑞”)、武汉嘉诺康医药技术有限公司(以下简称“嘉诺康”)转移至多瑞医药后,由公司推进募投项目的实施,后续由于研发产品项目补助申报、研发费用加计扣除政策等多方面的因素影响,将研发项目从子公司转移至多瑞医药在操作上较为复杂,因此公司新产品开发项目的具体实施主体尚未明确,公司在未变更“新产品开发项目”募投项目实施主体前,未使用募集资金,而是一直使用自有资金推进研发工作。
为满足新产品开发项目的实际开展需要,推进募投项目的实施进度,促进募投项目便捷开展,公司拟将募投项目“新产品开发项目”的实施主体由公司调整
为公司及全资子公司湖北多瑞和嘉诺康。2022 年 4 月 25 日公司已按照相关规定召开董事会和监事会,审议通过了《关于增加部分募投项目实施主体及使用募集资金向全资子公司增资实施募投项目的议案》,增加了湖北多瑞和嘉诺康作为募投项目实施主体,并及时履行了信息披露义务。
各个子项目的备案主体与变更后的实际执行主体具体情况如下:

2022 年 7 月,公司及湖北多瑞、嘉诺康已与恒丰银行股份有限公司武汉分行、保荐机构分别签订了《募集资金四方监管协议》。由于在开立相关募集资金专户之后,相关研发项目较少有募集资金支出需求,因此截至目前公司尚未使用募集资金进行投入,“新产品开发项目”的募集资金使用进度为 0。
2、“年产 1600 万袋醋酸钠林格注射液(三期)项目”规划进度与实际执行
进度的差异情况及进展缓慢的具体原因
1)“年产 1600 万袋醋酸钠林格注射液(三期)项目”规划进度与实际执行进度的差异情况
为了保障该项目科学、高效地顺利实施,2021 年 12 月,公司为该募投项目成立了专人项目组,陆续开展了项目单项招投标、项目落地规划定位、为设计院提供设计需求信息、确定平面方案、申请规划许可证、造价咨询、安全条件审查、设备造型考察和施工图设计等工作。公司对设计方案进行了多轮次的论证调整,
截止目前该项目设计方案已完成,尚未开工建设,项目规划进度与实际执行进度存在一定差异。
2)“年产 1600 万袋醋酸钠林格注射液(三期)项目”进展缓慢的具体原因
该项目进展缓慢的主要原因是基于 2022 年经营实际,结合 2022 年产销量,公司目前的产能可以满足当前需求,盲目扩大产能会对公司的经营产生较大压力。
2022 年以来,由于核心产品醋酸钠林格注射液陆续从各地方医保目录中调出,公司重点开发自费市场,相关的市场营销和推广存在一定的时间周期,导致销售收入下降;另外,受疫情多点反复影响,医院及社区的管控措施对公司业务开展产生了不利影响;受以上因素的叠加影响,2022 年销量下滑,产能利用率从2020 年、2021 年的 93.22%、118.05%下降至 2022 年的 73.75%。为充分保障募集资金的安全,公司谨慎推进该项目,未盲目开工建设,因而项目实施进度缓慢。
3、不存在影响项目可行性的实质性障碍
(1)公司对“新产品开发项目”进行调整主要是因为部分子项目涉及的外部市场环境发生了较大变化,以及部分子项目使用公司自有资金基本完成了研发阶段的主要工作。本次调整有利于提高募集资金的使用效率,优化募投项目结构,加快重点在研项目的实施进展。
(2)公司暂缓“年产 1600 万袋醋酸钠林格注射液(三期)项目”主要是因为 2022 年疫情、地方医保目录调整等因素导致销量下滑,且目前的产能利用率不足 80%,为充分保障募集资金的使用安全,因此该项目的实施进度缓慢。
综上所述,以上两个募投项目的调整主要是基于市场环境变化并经内部充分
论证后的审慎安排,不存在影响项目可行性的实质性障碍。
(二)历次募集资金使用专项报告是否披露了募投项目实际投资进度与投资计划存在差异的具体原因。
公司于 2021 年 9 月 29 日在创业板上市,截至目前,公司历次出具的募集资金使用专项报告的情况如下:
2022 年 3 月,公司 2021 年度《关于募集资金年度存放与使用情况的专项报告》中披露的“未达到计划进度或预计收益的情况和原因(分具体项目)”为“无”,募投项目实际投资进度与投资计划不存在差异。
2022 年 8 月,公司在《关于 2022 年半年度募集资金存放与使用情况的专项报告》中对“未达到计划进度或预计收益的情况和原因(分具体项目)”进行了披露,具体如下:“新产品开发项目”的若干子项目前期由湖北多瑞和嘉诺康以自有资金投入开展。2022 年 4 月 25 日第一届董事会第十二次会议审议通过《关于增加部分募投项目实施主体及使用募集资金向全资子公司增资实施募投项目的议案》后,“新产品开发项目”的实施主体由公司调整为公司及湖北多瑞、嘉诺康,有利于推进募集资金投资项目实施进程。”
虽然公司“年产 1600 万袋醋酸钠林格注射液(三期)项目”处于项目设计阶段,与计划进度相比略有滞后,但该项目的建设周期为 2 年,考虑后续可加快土建施工和设备购置及安装进程,预计仍可在规定时间内完工,不影响该项目的整体实施进度,故公司在《关于 2022 年半年度募集资金存放与使用情况的专项报告》中披露的“未达到计划进度或预计收益的情况和原因(分具体项目)”中不涉及“年产 1600 万袋醋酸钠林格注射液(三期)项目”。
二、保荐机构核查意见
(一)核查程序
1、查阅募投项目的可研报告,分析募投项目实施进度与项目规划进度是否存在差异;
2、访谈公司管理层,了解募投项目实施进度缓慢的原因,是否存在影响项目可行性的实质性障碍;
3、查阅公司历次募集资金年度存放与使用情况的专项报告的披露内容;
4、查阅募集资金台账、募集资金使用凭证。
(二)核查意见
经核查,保荐机构认为:
1、“新产品开发项目”的实施进展与规划进度不存在较大差异,募集资金使用进度缓慢主要由于:新产品开发项目备案主体和实施主体为多瑞医药,公司原计划将部分研发项目从子公司湖北多瑞、嘉诺康转移至多瑞医药后,由公司推进募投项目的实施,后续由于研发产品项目补助申报、研发费用加计扣除政策等多方面的因素影响,将研发项目从子公司转移至多瑞医药在操作上较为复杂,因此公司新产品开发项目的具体实施主体尚未明确,公司在未变更“新产品开发项目”募投项目实施主体前,一直使用自有资金推进“新产品开发项目”,未使用募集资金投入;
“年产 1600 万袋醋酸钠林格注射液(三期)项目”进展缓慢,主要原因是
由于受疫情、地方医保目录调整等因素的叠加影响,2022 年公司核心产品销量下滑,产能利用率下降不足 80%。为充分保障募集资金的安全,公司谨慎推进该项目,未盲目开工建设,因而截至目前该项目实施进度缓慢;
2、“新产品开发项目”和“年产 1600 万袋醋酸钠林格注射液(三期)项目”的调整主要是基于市场环境变化并经内部充分论证后的审慎安排,不存在影响项目可行性的实质性障碍;
3、(1)公司在 2021 年度《关于募集资金年度存放与使用情况的专项报告》中披露的“未达到计划进度或预计收益的情况和原因(分具体项目)”为“无”,募投项目实际投资进度与投资计划不存在差异。
(2)公司在《关于 2022 年半年度募集资金存放与使用情况的专项报告》中对“未达到计划进度或预计收益的情况和原因(分具体项目)”进行了披露,具体如下:“新产品开发项目”的若干子项目前期由湖北多瑞和嘉诺康以自有资金投入开展。2022 年 4 月 25 日第一届董事会第十二次会议审议通过《关于增加部分募投项目实施主体及使用募集资金向全资子公司增资实施募投项目的议案》后,“新产品开发项目”的实施主体由公司调整为公司及湖北多瑞、嘉诺康,有利于推进募集资金投资项目实施进程。”
虽然公司“年产 1600 万袋醋酸钠林格注射液(三期)项目”处于项目设计阶段,与计划进度相比略有滞后,但考虑后续可加快土建施工和设备购置及安装进程,预计仍可在规定时间内完工,不影响该项目的整体实施进度,故公司在《关于 2022 年半年度募集资金存放与使用情况的专项报告》中披露的“未达到计划进度或预计收益的情况和原因(分具体项目)”中不涉及“年产 1600 万袋醋酸钠林格注射液(三期)项目”。
问题二:
结合“新产品开发项目”前期立项规划及后续实施过程中市场环境、行业政策变化情况、公司自身战略规划,逐一说明本次拟变更的各个子项目的合理性,并说明新增子项目是否符合相关产业政策和当前市场情况。请你公司作出补充说明。
请保荐机构发表核查意见。
回复:
一、公司说明
(一)结合“新产品开发项目”前期立项规划及后续实施过程中市场环境、行业政策变化情况、公司自身战略规划,逐一说明本次拟变更的各个子项目的合理性。
公司以临床用药需求为导向,高度重视研发投入和技术创新,在血浆代用品细分领域形成了较强的市场地位和竞争优势,同时致力于塑造化学原料药和制剂“两翼齐飞”的业务格局,专注于临床价值高、市场前景广的高技术壁垒仿制药和改良型新药,积极挖掘现代临床需求。公司根据自身的战略规划,积极推动新产品的研发。
公司募投项目原“新产品开发项目”一共有 14 个子项目,其中有 10 个子项目发生变更,其中涉及投资金额变更的 5 个,涉及投资项目变更的 5 个。变更的
具体原因如下:
1、“碳酸氢钠林格注射液(500ml)”、“醋酸钠林格注射液(250ml)”、“复方醋酸钠林格注射液(250ml、500ml)”、“盐酸文拉法辛缓释胶囊(75mg、150mg)”、“碳酸氢钠注射液(1.4%,100ml)”等 5 个子项目变更的合理性
“碳酸氢钠林格注射液(500ml)”、“醋酸钠林格注射液(250ml)”已取得药品注册批件,“复方醋酸钠林格注射液(250ml、500ml)”和“盐酸文拉法辛缓释胶囊(75mg、150mg)”处于申报注册阶段,“碳酸氢钠注射液(1.4%,100ml)”处于已申报待受理阶段,上述 5 个子项目推进情况较好,后续支出不大,故将上述子项目从原募投项目中调出或调减投资金额。
2、其余 5 个子项目变更的合理性
1)“羟乙基淀粉 130/0.4 醋酸钠林格注射液(500ml)”2022 年 2 月,欧盟(EMA)安全委员会(PRAC)建议在欧盟境内暂停羟乙基淀粉注射液的上市许可;2022 年 9 月,国家药监局发布了关于修订羟乙基淀粉类注 射剂说明说明书的公告。以上指导性文件的出台使得该项目的外部市场环境发生较大变化,公司经审慎评估后认为该项目获批上市的可能性较小,决定暂停该项目,故将“羟乙基淀粉 130/0.4 醋酸钠林格注射液(500ml)”调出。
2)“舒更葡糖钠原料及注射液(200mg/2ml;500mg/5ml)”公司如果继续开展该项目,需继续投入较大资金用于设备购置,考虑到项目的投入和预期效益,决定终止该项目,故将“舒更葡糖钠原料及注射液(200mg/2ml;500mg/5ml)”调出。
3)“米库氯铵原料及注射液(5ml:10mg)”
截至目前,该产品同适应症品种厂家较多,竞争激烈,比如注射用维库溴铵,国内厂家数 18 家,通过一致性评价 1 家,正在申报一致性评价 2 家;罗库溴铵注射液,国内厂家数 14 家,进口厂家数 1 家,通过一致性评价 9 家,正在申报化药 4 类 7 家,正在申报一致性评价 1 家。公司决定暂停该项目,故将“米库氯铵原料及注射液(5ml:10mg)”调出。
4)“盐酸多巴胺原料”
截至目前,有 7 家企业生产盐酸多巴胺注射液(20mg/2ml),2 家企业生产注射用盐酸多巴胺(5mg、10mg 和 20mg),制剂市场竞争较大。根据目前研发进展及后续中试阶段安排,为提高募集资金使用效率,故将“盐酸多巴胺原料”调出,公司后续使用自有资金推进该项目。
5)“左西孟旦原料”
截至目前,国内有 8 家企业生产左西孟旦原料,其中有 4 家已批准在上市制剂中使用,市场竞争较大,公司决定终止该项目,故将“左西孟旦原料”调出。
(二)说明新增子项目是否符合相关产业政策和当前市场情况。
1、“益肺济生颗粒”的产业政策和市场情况
1)产业政策
“益肺济生颗粒”属于中药 1 类新药,近年来,国家颁布了一列中药相关的产业政策,大力支持中医药产业的发展,主要政策文件如下:
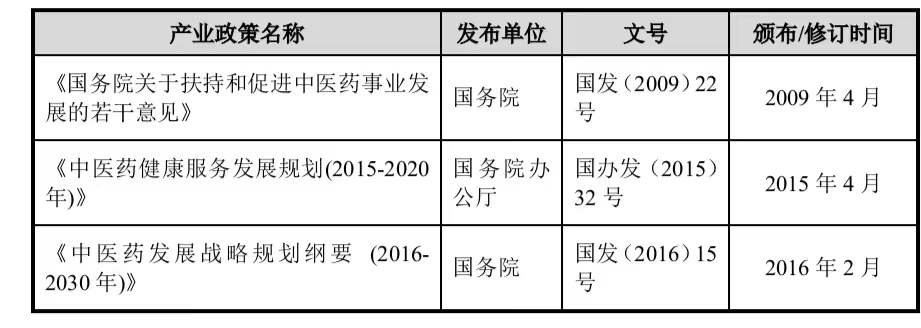
2023 年 2 月 10 日国家药监局发布的《中药注册管理专门规定》,进一步加强了对中药研制的指导,具有较强的实操性。可以预见,未来相关中药新药获批有望加速。并且 2022 年首 个经典名方获批上市、创新中药医保谈判结果积极等各方面因素,都将推进中药创新药加速发展。
2)市场情况
益肺济生颗粒主治慢性阻塞性肺疾病(简称“慢阻肺”)稳定期的肺肾气虚证患者。慢阻肺是严重危害公众健康的重大疾病、常见多发病、慢性进展性疾病,为 WHO 所列四大慢病之一,疾病负担重。《中国慢性阻塞性肺疾病分级诊疗报告(2020 年度)》显示,我国约有近 1 亿慢阻肺患者,40 岁及以上人群慢阻肺高危人群占比为 20.51%。
综上所述,“益肺济生颗粒”符合相关产业政策和当前市场情况。
2、“琥珀酰明胶电解质注射液”、“复方聚乙二醇 3350 电解质口服溶液”、“盐酸达泊西汀片”、“左卡尼汀口服溶液”、“注射用头孢唑肟钠”等仿制药的产业政策和市场情况
1)产业政策
仿制药相关产业的主要产业政策如下:
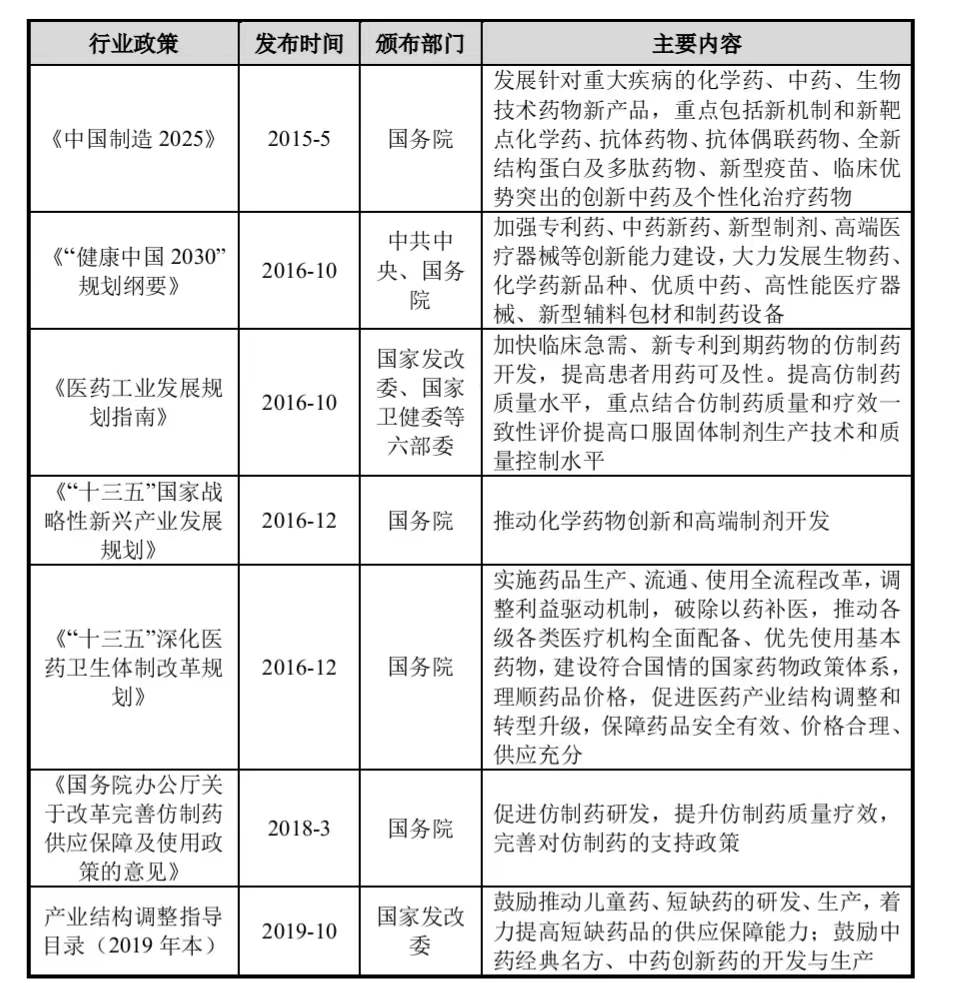
2)市场情况
本次新增 5 个仿制药研发项目,其中,盐酸达泊西汀片产品公司未来的销售渠道将主要围绕实体药店和网上药店,受到集采、两票制等相关政策的影响较小;其余 4 个产品目前通过一致性评价的厂家数量较少,未来随着通过一致性评价的厂家数量增加,可能会被纳入集采名单。公司正在加快该 4 个产品的研发,争取尽快通过一致性评价。
上述 5 个子项目的市场规模及竞争情况如下:

数据来源:米内网、国家药品监督管理局、国家药品监督管理局药品审评中心
综上所述,“琥珀酰明胶电解质注射液”、“复方聚乙二醇 3350 电解质口服溶液”、“盐酸达泊西汀片”、“左卡尼汀口服溶液”、“注射用头孢唑肟钠”等 5 个子项目符合相关产业政策和市场情况。
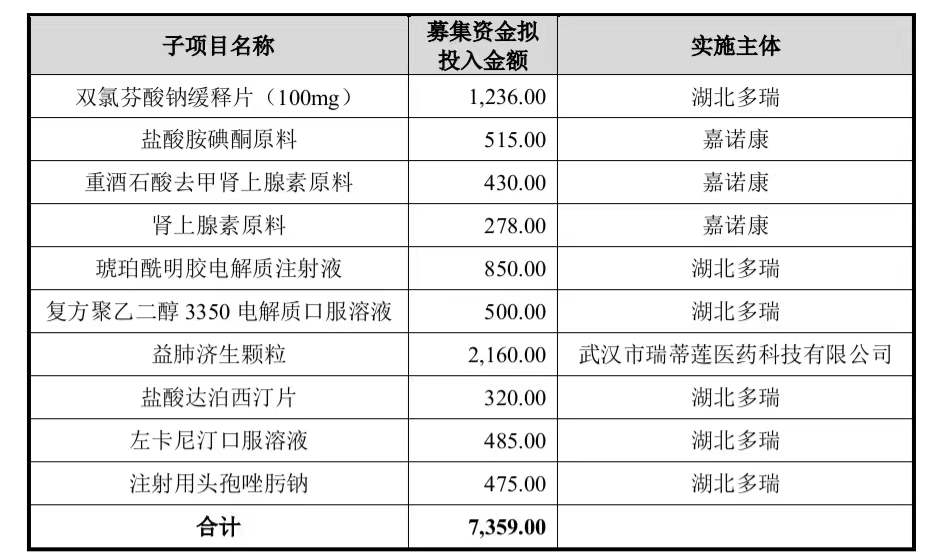
经上述调整后,“新产品开发项目”子项目的情况如下:

二、保荐机构核查意见
(一)核查程序
1、查阅公司“新产品研发项目”前期立项规划的可研报告;
2、访谈公司管理层,了解项目实施过程中市场环境、行业政策变化情况,以及拟变更的各个子项目的具体原因及合理性;
3、查阅新增子项目的立项报告,访谈公司管理层,了解新增子项目是否符合相关产业政策和当前市场情况。
(二)核查意见
经核查,保荐机构认为:
“新产品开发项目”本次拟变更的各个子项目具有合理性,新增子项目符合相关产业政策和当前市场情况。
问题三:
说明“年产 1600 万袋醋酸钠林格注射液(三期)项目”实施的可行性、市场环境、行业政策是否发生重大变化,募投项目暂缓实施是否会对公司的核心竞争力产生重大不利影响以及拟采取的应对措施,该项目立项阶段是否进行充分调查分析、是否充分考虑市场及行业变化风险,并充分提示募投项目暂缓实施的相关风险。请你公司作出补充说明。
请保荐机构发表核查意见。
回复:
一、公司说明
(一)说明“年产 1600 万袋醋酸钠林格注射液(三期)项目”实施的可行性、市场环境、行业政策是否发生重大变化。
1、项目实施的可行性、行业政策未发生重大变化近年来,国家陆续出台了一系列鼓励和支持医药行业发展的法律法规及产业政策。2015 年 5 月 8 日,国务院颁布的《中国制造 2025》中指出,要发展针对重大疾病的化学药、生物技术药物等新产品;2016 年 10 月 25 日,国务院颁布的《“健康中国 2030”规划纲要》指出要加强专利药、新型制剂等创新能力的建设;2016 年 11 月 7 日,国家发改委等六部委联合颁布的《医药工业发展规划指南》中提到,“十三五”期间,高端制剂为化学药的重点发展领域。同时还指出要加快临床急需、专利到期药物的仿制药开发,提高患者用药可及性,重点结合仿制药质量和疗效一致性评价提高化学制剂生产技术和质量控制水平;2018 年 4 月 3日,国务院发布《国务院办公厅关于改革完善仿制药供应保障及使用政策的意见》,指出要促进仿制药研发,提升仿制药质量疗效,完善对仿制药的支持政策;2019年 10 月 30 日,国家发改委发布《产业结构调整指导目录(2019 年本)》,鼓励推动儿童药、短缺药的研发、生产,着力提高短缺药品的供应保障能力,鼓励中药经典名方、中药创新药的开发与生产。项目实施具备政策可行性。
本项目建设的生产线用于公司的核心产品醋酸钠林格注射液的生产。根据米内网中国城市公立医院数据库显示,2021 年我国血浆代用品和输注液的市场规模达到 6,059,465 万元,较 2020 年同比增长 9.77%,2013-2021 年期间的年均复合增速约 6.41%。其中醋酸钠林格注射液呈现快速增长态势,从 2013 年的 4,809万元增长至 2021 年的 62,467 万元,年复合增速达到 32.96%。因此,公司拟通过本项目的实施,快速扩大醋酸钠林格注射液的生产规模,从而满足下游市场对公司核心产品的市场需求,巩固并提升公司产品的市场占有率。因此,项目实施具备市场可行性。
综上,公司“年产 1600 万袋醋酸钠林格注射液(三期)项目”实施的可行性、行业政策未发生重大变化。
2、项目实施的市场环境发生重大变化
该项目由于疫情、地方医保目录到期调等因素导致所处的市场环境发生较大变化。2022 年度,公司核心产品醋酸钠林格注射液陆续从各地方医保目录中调出,公司重点开发自费市场,相关的市场营销和推广存在一定的时间周期,导致销售收入下降;受疫情影响,医院及社区的管控措施对公司业务开展产生了不利影响。
(二)募投项目暂缓实施是否会对公司的核心竞争力产生重大不利影响以及拟采取的应对措施。
1、募投项目暂缓实施不会对公司的核心竞争力产生重大不利影响
公司 2022 年综合产能利用率不足 80%,当前产能处于富余状态。如果后续市场需求逐步恢复,而重启募投项目并完成产能建设尚需一定时间时,公司可通过委外生产的方式及时满足市场需求,不会对公司的核心竞争力产生重大不利影响。
2、公司拟采取的应对措施
1)密切关注公司产品醋酸钠林格注射液需求的变化,及时满足市场需求由于疫情、地方医保政策到期调整等因素影响,公司核心产品醋酸钠林格注射液的销售承受较大压力。随着防疫政策放开后,医院住院病人和手术量会有一定程度增加,可能促使对核心产品的需求增加。公司会密切关注外部市场环境的变化,通过委外加工或扩大产能等方式及时满足市场需求。
2)丰富产品管线,增加利润来源
公司会加快推进化学原料药和制剂的产品布局。在原料药方面,公司主要在研的项目已陆续进入中试阶段,公司将加快推进相关产品的后续研发进展,尽快完成申报备案;在制剂方面,除了在研产品管线外,公司也将充分利用资本市场优势,积极推进外延发展,加快制剂产品的布局。
(三)该项目立项阶段是否进行充分调查分析、是否充分考虑市场及行业变化风险。
深圳深投研顾问有限公司于 2020 年 3 月对该项目出具了《湖北多瑞药业有限公司年产 1600 万袋醋酸钠林格注射液(三期)项目可行性研究报告》,认为实施该项目可扩大产能、满足市场的持续增长需求,进一步提升生产能力、巩固公司的行业地位,改善产品工艺水平、确保产品的质量。同时,该项目在政策上、市场上、人员和技术上均具有可行性。因此,该项目在立项阶段进行了充分调查分析。
上述可行性研究报告中专门阐述了项目建设风险及相应的控制措施。其中提到“国内产品市场的竞争激烈程度有可能提高,这将使得本项目面临一定的市场竞争风险”。因此,该项目立项阶段已充分考虑市场及行业变化风险。
综上所述,该项目立项阶段进行了充分调查分析并充分考虑市场及行业变化风险。
(四)充分提示募投项目暂缓实施的相关风险。
公司在《关于对深圳证券交易所关注函的回复公告》开篇对“年产 1600 万袋醋酸钠林格注射液(三期)项目”暂缓实施的相关风险进行充分提示,具体如下:
“重大风险提示:
1、募投项目“年产 1600 万袋醋酸钠林格注射液(三期)项目”暂缓导致项目进展不达预期,影响项目的预期收益。
2、公司将根据外部环境变化以及自身实际情况确定“年产 1600 万袋醋酸钠林格注射液(三期)项目”后续实施计划,是否继续实施具有不确定性。敬请广大投资者理性投资,注意风险。”
二、保荐机构核查意见
(一)核查程序
1、查阅“年产 1600 万袋醋酸钠林格注射液(三期)项目”的可研报告,了解项目立项阶段的调查分析情况是否充分,是否充分考虑市场及行业变化风险;
2、访谈公司管理层,了解该募投项目实施的可行性、市场环境、行业政策是否发生重大变化;询问该募投项目暂缓实施是否会对公司的核心竞争力产生重大不利影响以及公司拟采取的应对措施;了解该募投项目的暂缓实施是否存在相关风险。
(二)核查意见
经核查,保荐机构认为:
1、“年产 1600 万袋醋酸钠林格注射液(三期)项目”实施的可行性、行业政策未发生重大变化,项目实施的市场环境发生重大变化;
2、上述募投项目暂缓实施不会对公司的核心竞争力产生重大不利影响;
3、公司在上述募投项目立项阶段进行了充分调查分析,充分考虑市场及行业变化风险;
4、公司在《关于对深圳证券交易所关注函的回复公告》中已充分提示“年产 1600 万袋醋酸钠林格注射液(三期)项目”暂缓实施的相关风险。
问题四:
分别说明前述两个募投项目实施情况发生变化的具体时点,说明历次披露的《募集资金存放与实际使用情况的专项报告》中关于募投项目可行性的披露是否真实、准确,公司是否存在信息披露不审慎、不及时的情况,是否存在违反募集资金使用及管理相关规定的问题。请你公司作出补充说明。
请保荐机构发表核查意见。
回复:
一、公司说明
(一)分别说明前述两个募投项目实施情况发生变化的具体时点
暂缓“年产 1600 万袋醋酸钠林格注射液(三期)项目”和变更“新产品开发项目”主要是因为市场环境发生变化,不涉及某个具体的时间点。
2022 年,疫情防控形势仍然严峻,各地防疫政策趋紧,未来防疫政策仍不明朗,医院就诊量和手术病人数均低于同期;同时,除安徽省外,公司核心产品醋酸钠林格注射液陆续从其他地方医保目录中调出。受上述因素的叠加影响,公司2022 年三、四季度的销售仍未出现明显改善。2022 年 10 月,公司已向国家药品监督管理局提交了醋酸钠林格注射液的一致性评价申请,但由于 2022 年下半年
整体市场环境未有所改善,2023 年 1 月公司管理层经反复论证,结合现有产能利用率情况,为充分保障募集资金的安全,决定暂缓实施“年产 1600 万袋醋酸钠林格注射液(三期)项目”并于 2023 年 1 月召开总经理办公会。2023 年 2 月公司召开第一届董事会第二十次会议和第一届监事会第十八次会议,审议通过了《关于暂缓实施部分募投项目的议案》,同意暂缓实施“年产 1600 万袋醋酸钠林格注射液(三期)项目”。未来,公司将根据市场环境政策的变化情况、核心产品醋酸钠林格注射液一致性评价申请进度,以及其他产品的布局情况,合理统筹规划产能扩建方案。
变更“新产品开发项目”主要是由于部分子项目所涉及的外部市场环境发生了较大变化和部分子项目使用公司自有资金基本完成了研发阶段的主要工作。考虑到募集资金使用效率,为满足新产品开发项目的实际开展需要,2023 年 1 月公司管理层经内部论证,决定对原“新产品开发项目”中的部分子项目进行调整,并于 2023 年 1 月召开总经理办公会。公司于 2023 年 2 月召开第一届董事会第二十次会议和第一届监事会第十八次会议,审议通过了《关于变更部分募投项目、新增募投项目实施主体及使用募集资金向控股子公司出资和提供借款实施募投项目的议案》。
(二)历次披露的《募集资金存放与实际使用情况的专项报告》中关于募投
项目可行性的披露是否真实、准确,公司是否存在信息披露不审慎、不及时的情况,是否存在违反募集资金使用及管理相关规定的问题。
1、关于募投项目可行性的披露
由于上述两个募投项目可行性均未发生重大变化,故 2021 年度《募集资金存放与实际使用情况的专项报告》和《关于 2022 年半年度募集资金存放与使用情况的专项报告》均未披露项目可行性发生重大变化的情况说明。上述披露内容真实、准确,不存在信息披露不审慎、不及时的情况。
2、关于募集资金使用和管理
公司已按照相关法律法规建立《募集资金管理办法》,明确了募集资金使用的分级审批权限、决策程序、风险控制措施及信息披露要求。
公司对募集资金采取专户存储管理,并与保荐机构、募集资金专户所在银行签订募集资金监管协议。公司在募集资金使用过程中,涉及的募集资金置换、增加募投项目实施主体、变更部分募投项目实施地点及实施方式、使用闲置募集资金进行现金管理、使用超募资金永 久补充流动资金、拟暂缓部分募投项目和变更部分募投项目的事项,均已按照相关法律法规及募集资金使用制度履行了相应的决策程序及信息披露义务,不存在违反募集资金使用及管理相关规定的问题。
二、保荐机构核查意见
(一)核查程序
1、访谈公司管理层,了解两个募投项目实施情况发生变化的时间;
2、获取两个募投项目实施情况拟发生变化的相关会议纪要、三会文件;
3、查阅公司历次募集资金年度存放与使用情况的专项报告的披露内容。
(二)核查意见
经核查,保荐机构认为:
1、公司历次披露的《募集资金存放与实际使用情况的专项报告》中关于募投项目可行性的披露真实、准确;
2、公司关于募集资金的信息披露审慎、及时,不存在违反募集资金使用及管理相关规定的问题。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030