https://www.cphi.cn 2023-03-13 13:02 来源:药渡Daily 作者:石榴
消息速递
2023年3月8日,国家药品监督管理局(NMPA)批准上海海和药物研究开发股份有限公司申报的1类创新药谷美替尼片(商品名:海益坦®,研发代号:SCC244)上市。该药品适用于具有间质-上皮转化因子(MET)外显子14跳变(METex14跳变)的局部晚期或转移性非小细胞肺癌(NSCLC)的治疗。
谷美替尼能够选择性抑制c-Met激酶活性,进而抑制肿瘤细胞的增殖、迁移和侵袭。该药品的上市为具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌患者提供了新的治疗选择。
来源:NMPA官网
非小细胞肺癌(NSCLC)患者中存在大量因METex14跳变而未被满足的临床需求
中国肺癌患者人数占全世界肺癌患者总数的三分之一以上。肺癌通常分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中80-85%为非小细胞肺癌。大部分非小细胞肺癌患者在确诊时已是晚期,而大约25-30%的患者在确诊时有机会接受手术治疗。在有机会接受手术治疗的患者中,大部分患者虽然接受了完全肿瘤切除手术和辅助化疗,最终仍会复发。
美国和欧洲约有10-25%的非小细胞肺癌患者存在EGFR突变,而亚洲患者中该比例高达30-40%。这些患者对EGFR 酪氨酸激酶抑制剂(“TKI”)的治疗特别敏感,这种抑制剂可阻断驱动肿瘤细胞生长的信号传导途径。
MET是一种受体酪氨酸激酶,MET变异在实体瘤中广泛存在,包括胃肠道肿瘤、头颈部肿瘤和肺癌。MET扩增或过表达不仅可在未经过治疗的患者中出现,亦是EGFR突变的转移性非小细胞肺癌患者使用EGFR TKI治疗后获得性耐药的主要机制之一。非小细胞肺癌 (NSCLC) 中的MET变异方式包括突变、扩增或基因融合。其中MET外显子14(METex14)跳变作为MET异常的一种常见形式,在新诊断的非小细胞肺癌患者中,约有2%-3%的患者伴有METex14跳变,这是一种特定的基因突变,在中国NSCLC人群中的发生率约1.3%。
METex14跳变是原发致癌驱动基因,通常不与EGFR、 KRAS和ALK等肺癌其他突变共存。METex14跳变预示预后差,化疗药物二线治疗无进展生存时间(PFS)仅为2.9个月,总生存期(OS)为7.9-8.3个月。免疫治疗用于METex14跳变患者获益有限,ORR为16~17%,中位PFS为1.9~3.4个月。
c-MET赛道继续卷,竞争日趋白热化
目前,全球范围内,只有四款针对METex14跳变的小分子抑制剂获批上市,分别是默克的特泊替尼、诺华的卡马替尼、和黄医药的赛沃替尼、以及海和医药的谷美替尼,均针对NSCLC患者。
NCCN指南(2022版)对于NSCLC一线全身治疗前检出METex14跳变的患者,首选方案:卡马替尼、特泊替尼;某些情况下可选择克唑替尼。克唑替尼可作为NSCLC中出现ROS1突变的首选方案。一定条件下,克唑替尼还可用于NSCLC中出现ALK突变的患者。卡博替尼还可作为RET突变的其他方案。
据药渡数据的不完全统计,全球范围内,共有46款单靶点c-MET小分子抑制剂在研,其中1款处于NDA阶段,1款处于临床3期。在国内,共有22款单靶点c-MET抑制剂在研,其中3款处于NDA阶段,1款处于临床2期。研发进度较快的是冠科美博/浦润奥生物的伯瑞替尼,2022年的新药上市申请已被CDE纳入优先审评程序。
而对于多靶点酪氨酸激酶小分子抑制剂而言,全球范围内,共有52款药物在研,其中3款药物已上市,分别为Xcovery的恩沙替尼、辉瑞的克唑替尼、以及Exelixis的卡博替尼(国内未上市),2款处于NDA阶段,3款处于临床3期。在国内,共有24款药物在研,3款处于NDA阶段,1款处于临床3期,研发进度较快的是正大天晴的TQ-B3101和TQ-B3139。两款药物均为ALK/MET/ROS1抑制剂,正分别针对ROS1阳性和ALK阳性NSCLC推进上市审评进程,而其布局的临床试验,也涵盖到了METex14跳变的NSCLC。
靶向c-MET的抗体药物中,全球范围内共有13款药物在研,国内共有8款药物在研,其中3款处于临床2期。研发进度较快的分别是嘉和生物的GB-263(三抗)、岸迈 生物的Bafisontamab(巴弗妥单抗,双抗)、以及Merus Nv/贝达药业的MCLA-129(双抗),这3款药物的靶点均是EGFR和c-MET。
中国首 款——赛沃替尼(商品名:沃瑞沙®/ORPATHYS®)
赛沃替尼(旧称沃利替尼)可选择性抑制MET激酶的磷酸化,对METex14跳变的肿瘤细胞增殖有明显的抑制作用。该品种为我国首 个获批的特异性靶向c-MET激酶的小分子抑制剂,其上市为具有METex14跳变的晚期非小细胞肺癌(NSCLC)患者提供了新的治疗选择。
2021年6月23日,赛沃替尼在中国通过优先审评审批程序获附条件批准上市。该药为我国拥有自主知识产权的创新药,用于含铂化疗后疾病进展或不耐受标准含铂化疗的、具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌成人患者。
支持赛沃替尼在中国上市注册的获批是基于一项中国II期试验(NCT02897479)。中位随访时间为17.6个月,所有使用赛沃替尼治疗的受试者的客观缓解率(ORR)为42.9%,中位无进展生存期(PFS)为6.8个月。整个研究人群的疾病控制率(DCR)为 82.9%。赛沃替尼的安全性和耐受性特征与之前的研究结果一致,没有发现新的安全性问题。持续批准取决于在该患者人群中成功完成确证性试验(NCT04923945)。
2022年,赛沃替尼(沃瑞沙®)的市场销售额增长159%至4,120万美元(2021年:1,590万美元)。由于沃瑞沙®为中国首 个选择性MET抑制剂,作为自费药物上市初期便迅速获市场认可。该药物自2023年3月1日起将获纳入国家医保药品目录,原价8588元/盒/200mg,进入医保后5289元/盒/200mg,市场认可度将有望继续提升。
权益合作
继赛沃替尼由和黄医药自主研发及初步开发后,和黄医药与阿斯利康于2011年达成一项全球许可和合作协议,旨在共同开发赛沃替尼并促进其商业化。根据协议,和黄医药主导赛沃替尼在中国的临床开发,并由阿斯利康主导其海外开发。和黄医药负责赛沃替尼在中国的上市许可、生产和供应,而阿斯利康则负责赛沃替尼在中国乃至全球范围内的商业化。赛沃替尼的销售收入由阿斯利康确认。
目前,赛沃替尼正作为单药疗法或与其他药物的联合疗法,临床开发用于治疗包括肺癌、肾癌和胃癌在内的多种肿瘤类型。
于2022年WCLC公布的与泰瑞沙®的联合疗法治疗伴有EGFR突变及MET扩增或过表达的非小细胞肺癌患者的SAVANNAH全球II期研究(NCT03778229),结果显示,在既往未接受化疗的高MET水平的二线以上非小细胞肺癌患者中的疾病缓解率为52%及缓解持续时间为9.6个月。整体结果表明,伴有较高MET异常水平尤其是既往未接受过化疗的患者中的ORR、DoR及PFS较高。
赛沃替尼联合泰瑞沙®用于治疗因MET扩展引起的EGFR TKI治疗后进展的患者(TATTON研究,NCT02143466)是一项全球探索性研究。在接受第一代或第二代EGFR TKI治疗后疾病进展的三个患者队列中,ORR为64.7-66.7%,中位PFS为9.0-11.1个月。在接受第三代EGFR TKI治疗后疾病进展的患者队列中,ORR为33.3%,中位PFS为5.5个月。该联合疗法展现出令人鼓舞的抗肿瘤活性及可接受的风险获益特征。
赛沃替尼单药治疗MET驱动的乳头状肾细胞癌(SAVOIR研究,NCT03091192)是一项比较赛沃替尼单药疗法与舒尼替尼单药疗法的全球研究。赛沃替尼表现出令人鼓舞的疗效,ORR为27%,而舒尼替尼的ORR则为7%。至数据截止时,对赛沃替尼有反应的患者均未出现疾病进展,总生存期(OS)的风险比(HR)为0.51,中位生存期尚未到达。
赛沃替尼联合英飞凡®PD-L1抑制剂用于治疗肾细胞癌(CALYPSO研究,NCT02819596) 的开放标签I/II期临床试验中,分析该研究中41名乳头状肾细胞癌患者的数据,其中14名MET驱动的患者中8名达到确认反应(57%),中位缓解持续时间(DoR)为9.4个月,中位PFS为10.5个月,中位OS为27.4个月。而在该研究中没有出现新的安全信号。
IKTORY是一项由研究者发起于南韩进行的针对胃癌的II期伞式研究,共有715名患者接受测序后纳入分子驱动的患者组,其中包括伴有MET扩增的胃癌患者。伴有MET扩增的患者接受赛沃替尼单药治疗,结果显示ORR为50%(10/20名)。
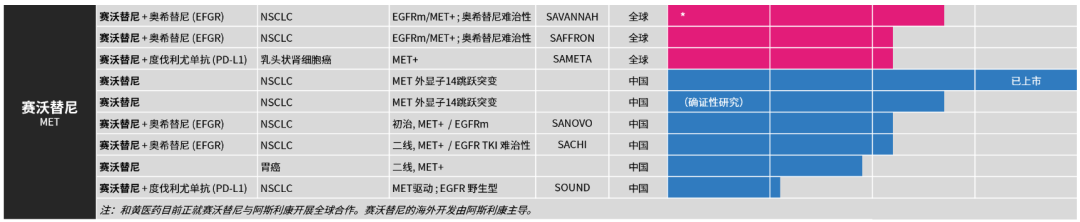
来源:和黄医药官网
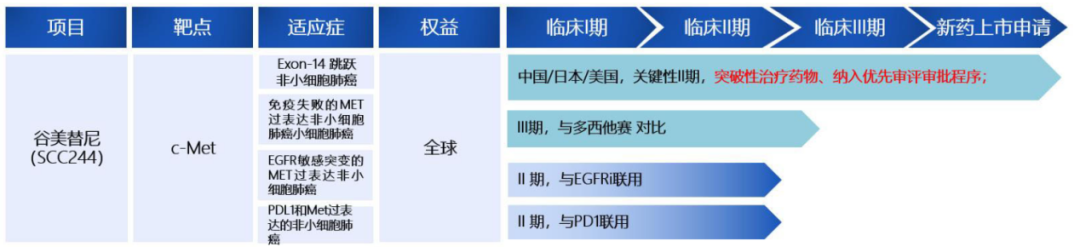
中国第二款——谷美替尼(商品名:海益坦®,研发代号:SCC244)
谷美替尼片是由海和药物与中国科学院上海药物研究所合作研发的一款口服、强效、高选择性小分子c-MET抑制剂。临床前研究显示谷美替尼片可强效和特异性靶向抑制MET激酶活性。临床研究结果显示,谷美替尼片具有优良的药代动力学特性以及良好的安全性和耐受性,在具有MET改变的晚期非小细胞肺癌患者中显示了明确疗效且脑转移患者同样获益。这是中国第二款获批的特异性靶向MET激酶的小分子抑制剂。在中国,谷美替尼被纳入突破性治疗药物品种,其新药上市申请被纳入优先审评审批程序。在美国,谷美替尼被授予了孤儿药资格。
在支持谷美替尼片在中国上市注册的一项开放、国际、多中心的单臂II期研究(GLORY研究,NCT04270591)中,谷美替尼片对于具有METex14跳变的初治和经治局部晚期或转移性非小细胞肺癌患者均高度有效且安全可控。
GLORY研究中79例经中心实验室确认为METex14跳变患者12个月随访数据显示:由盲态独立影像评估委员会(BIRC)评估的总体客观缓解率(ORR)为65.8%,其中初治患者ORR更优为70.5%,经治患者ORR也达到60.0%,中位无进展生存期(mPFS)总体人群8.5个月,其中初治患者达11.7个月,经治患者7.6个月;中位总生存期(mOS)总体人群17.3个月,其中初治患者尚未达到,经治患者16.2个月,疗效明确;安全性方面,整体安全耐受,常见不良反应为水肿,无潜在光毒 性,亦未观察到相关的过敏反应,药物相互作用少,合并用药安全性风险较低。
截止2023年3月8日,与已上市同类产品相比,谷美替尼稳态谷浓度比同类产品更高,可以持续抑制靶点; 半衰期长,适合每日一次给药; 不需要根据体重做剂量调整; 药物相互作用少,合并用药安全性风险低。
目前,谷美替尼正作为单药疗法或与其他药物的联合疗法,临床开发用于治疗肺癌。
来源:海和医药官网
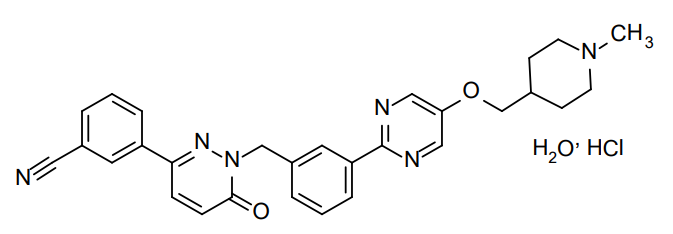
全球首 款——特泊替尼(商品名:Tepmetko)
特泊替尼(英文商品名:Tepmetko)是默克开发的一种高选择性口服MET抑制剂,旨在抑制MET基因变异引起的致癌MET受体信号,包括METex14跳跃改变、MET扩增或MET蛋白过表达。这是全球首 款获批上市的METex14跳变小分子抑制剂。在日本,特泊替尼被授予了孤儿药资格(ODD)和SAKIGAKE资格(创新药物)。在美国,特泊替尼被授予了孤儿药资格和突破性药物资格。
2020年3月25日,日本厚生劳动省批准特泊替尼上市,用于治疗不可切除、METex14跳变的晚期或复发性NSCLC患者。
2021年2月3日,美国FDA加速批准特泊替尼用于具有METex14跳变的转移性NSCLC成人患者。
2022年2月22日,欧盟委员会批准特泊替尼作为一种单药,用于伴有METex14跳变的NSCLC患者。
2022年3月30日,德国默克向中国NMPA申报了盐酸特泊替尼片的新药上市申请(受理号:JXHS2200033),并获得受理。
特泊替尼的获批上市基于VISION的关键性II期临床试验(NCT02864992)的支持。总计152名携带METex14跳跃变异的晚期或转移性NSCLC患者接受了特泊替尼的单药治疗。他们不携带EGFR或ALK基因突变。
试验结果显示,特泊替尼在初治和经治患者中均达到43%的总缓解率。初治和经治患者的中位缓解持续时间(DOR)分别为10.8个月和11.1个月。67%的初治患者和75%的经治患者的缓解持续时间为6个月以上,30%的初治患者和50%的经治患者的缓解持续时间为9个月以上。
特泊替尼被设计用于改善预后较差并具有这些特定突变的侵袭性肿瘤的预后,拟开发适应症包括NSCLC、肝细胞癌、结直肠癌和其它存在MET突变的实体瘤。
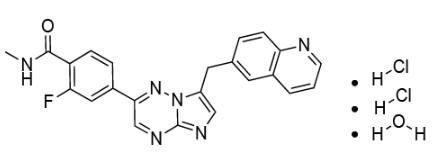
美国首 款——卡马替尼(研发代码:INC280)
卡马替尼(研发代码:INC280)是诺华开发的一种高选择性口服、ATP竞争性的c-MET激酶抑制剂,能有效抑制c-MET依赖性肿瘤细胞的增殖和迁移,并有效诱导细胞凋亡。这是美国首 款获批上市的METex14跳变小分子抑制剂。在美国,卡马替尼被授予了孤儿药资格和突破性药物资格。
2020年5月6日,美国FDA批准卡马替尼用于具有METex14跳变的转移性NSCLC成人患者。目前,卡马替尼在中国还处于临床试验中。
卡马替尼的获批基于一项名为“GEOMETRY mono-1”的II期临床研究(NCT02414139)。研究在携带METex14的EGFR野生型、ALK阴性、转移性NSCLC成人患者中进行。对于初治患者总有效率(ORR)达65.6%,既往接受过治疗患者ORR达51.6%,中位总生存时间(OS)分别为20.8个月和13.6个月。
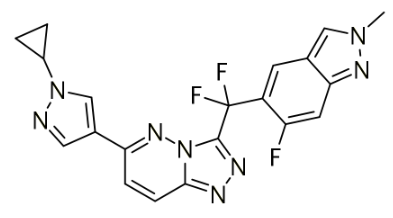
伯瑞替尼(APL-101,PLB1001)
伯瑞替尼(APL-101,PLB1001)是一种新型的、強效的、具有选择性及口服生物可用的强效小分子c-MET抑制剂,靶向多种肿瘤c-MET失调通路。其为一种具有选择性且强效的c-MET受体激酶(于多种肿瘤类型中过度表达及/或突变)的抑制剂。在中国,伯瑞替尼被纳入了突破性治疗品种,其新药上市申请被纳入了优先审评审批程序。在美国,伯瑞替尼被授予了孤儿药称号。
伯瑞替尼已经在具有c-MET扩增的多种人原发性胃癌、肝癌、胰 腺癌和肺癌异种移植动物模型中显示出临床前肿瘤抑制作用,具有高度专一(靶向)性,并能通过血脑屏障。1期临床试验证明了伯瑞替尼的安全性和耐受性,冠科美博选择了一个剂量推进到2期试验。浦润奥生物在中国进行的1期临床试验中,伯瑞替尼亦在具有METex14跳跃突变及/或MET 扩增的受试者显示出初步抗肿瘤活性。
伯瑞替尼最初是由冠科美博(原中美冠科)的科学家针对c-MET靶点研究后设计出的一个化合物。之后,冠科美博将该产品的中国权益授权给浦润奥,将中国以外权益留在公司自己手中。
最新关键注册研究(SPARTA研究,NCT04258033)结果显示,接受伯瑞替尼治疗的52例晚期 METex14跳变NSCLC患者已达到预设主要终点,患者客观缓解率(ORR)达到75%,疾病控制率(DCR)高达96.2%,中位无进展生存期(mPFS)为12个月,中位缓解持续时间(mDOR)为16.7个月。其中,初治患者和经治患者的ORR分别可达到77.1%和70.6%。亚组分析显示,伯瑞替尼对颅内转移患者也有非常好的疗效,颅内ORR达到62.5%,可测量中枢神经转移(CNS)颅内ORR达到100%。
小结
目前中国已有2款c-MET抑制剂获批上市,预计到2023年底将有4-5款c-MET小分子抑制剂(浦润奥生物的伯瑞替尼、默克的特泊替尼、正大天晴的TQ-B3101和TQ-B3139、诺华的卡马替尼)在中国获批上市,呈现出百家争鸣的局面,c-MET赛道的竞争也将进入白热化阶段。
作为国内首 款获批且已进入医保的赛沃替尼,可谓是抢占市场先机,紧随其后的谷美替尼有望在METex14蓝海竞争中分一杯羹。但市场留给谷美替尼的时间只有几个月,接着便会有多款药物上市。如何能在该赛道脱颖而出,以差异化获得市场认可是摆在这些药企面前的难题。期待接下来的新药陆续上市,惠及更多患者!
信息来源:
药渡数据库;
各公司官网;
NMPA官网;
NCCN指南;
Jing A. et al. Preclinical Evaluation of SCC244 (Glumetinib), a Novel, Potent, and Highly Selective Inhibitor of c-Met in MET-dependent Cancer Models [J]. Mol Cancer Ther. 2018 Apr;17(4):751-762.
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030