https://www.cphi.cn 2023-03-13 10:15 来源:药智头条 作者:森林
本期(2023年3月3日至2023年3月10日),新药研发周期长、风险高,即便是已进入注册申请阶段也有可能不被批准。多款新药报产迎来新进展,海和药物谷美替尼片附条件获批上市,儿童肿瘤药双羟萘酸曲普 瑞林获批进口,遗憾的是恒瑞/万春医药的普那布林未获得批准。此外,还有多款新药申报上市,来自康宁杰瑞、赛诺菲等企业,更多动态如下:
国内审评审批·新动态
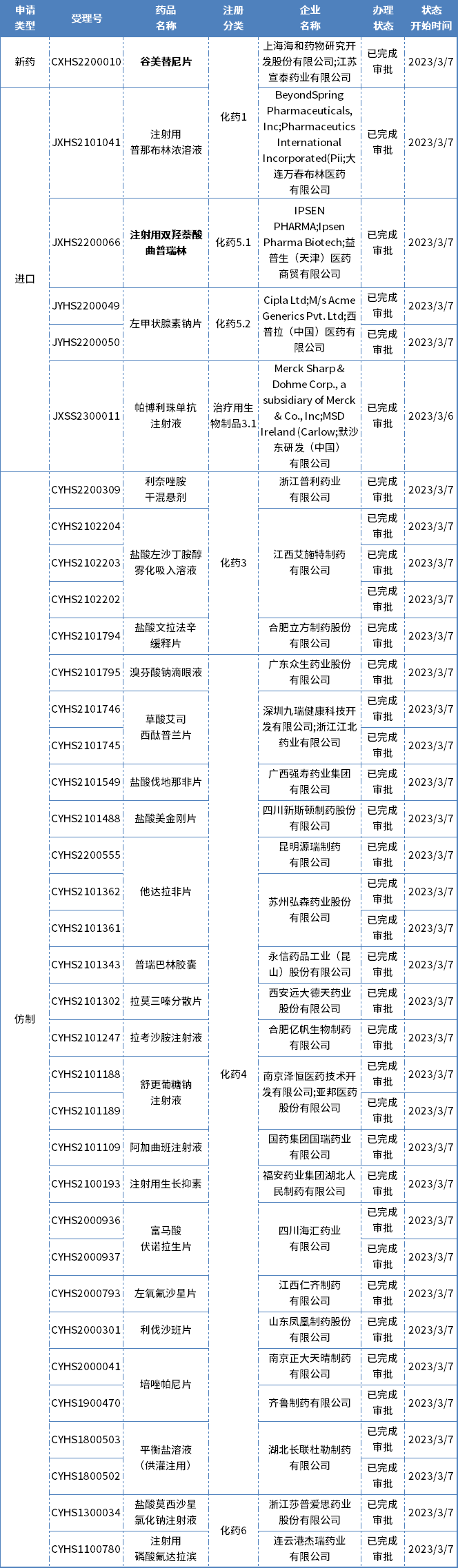
本期CDE有36个受理号(26个品种)报生产办理状态更新,其中上海海和药物的谷美替尼片和益普生的注射用双羟萘酸曲普 瑞林备受关注,更多动态如下:
数据来源:药智数据
肺癌1类新药谷美替尼片获批上市
3月8日,国家药品监督管理局附条件批准上海海和药物研究开发股份有限公司申报的1类创新药谷美替尼片上市,用于具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌的治疗。
谷美替尼(Glumetinib,代号:SCC244)是海和药物与中国科学院上海药物研究所合作研发的具有全球自主知识产权1类新药,能够选择性抑制c-Met激酶活性,进而抑制肿瘤细胞的增殖、迁移和侵袭。
此前,谷美替尼曾被NMPA纳入突破性治疗品种名单,还被美国FDA授予具有MET基因变异的非小细胞肺癌孤儿药资格。本次通过优先审评附条件获批,为具有间质—上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌患者提供了新的治疗选择。
截至目前,今年NMPA已经批准了四款国产1类创新药上市,包括海和药物的谷美替尼片、恒瑞医药的阿得贝利单抗注射液、柯菲平的盐酸凯普拉生片和江苏艾迪药业申报的1类创新药艾诺米替片。
儿童肿瘤新药「双羟萘酸曲普 瑞林」获批进口
近日,NMPA批准了益普生的注射用双羟萘酸曲普 瑞林新适应症上市申请。该申请曾以“符合儿童生理特征的儿童用药新品种、剂型和规格”被纳入优先审评,适应症为局部晚期和转移性前列腺癌、子宫内膜异位症、中枢性性早熟(8岁前的女孩和10岁前的男孩)。
曲普 瑞林是天然促性腺激素释放激素(GnRH)的类似物,动物研究和人体研究表明,初始刺激后,长期使用曲普 瑞林可抑制促性腺激素的分泌,从而抑制睾丸的功能。早在2008年11月,就国家药监局批准用于局部晚期或转移性前列腺癌的治疗
值得一提的是,丽珠制药的2.2类新药注射用双羟萘酸曲普 瑞林微球已在2021年3月获批临床。据健康元公告,该产品每三月一次肌肉注射,相比普通曲普 瑞林注 射剂,具有起效时间长,减少用药次数特点,可减轻患者痛苦和用药负担,提高用药耐受性和可及性。
国内审评审批·新受理
本期CDE新增报生产受理号88个,共60个品种,其中康宁杰瑞的地舒单抗注射液和赛诺菲的度普利尤单抗注射液备受关注,更多动态见下表:

数据来源:药智数据
康宁杰瑞提交地舒单抗生物类似药上市申请
据药智数据,康宁杰瑞近日提交了地舒单抗注射液的上市申请,并获得受理。
地舒单抗是安进开发的一种核因子B配体受体激活剂(RANKL),于2010年5月首次在欧盟获批上市。原研根据规格和适应症分为两个不同的品牌:Xgeva(安加维,70 mg/ml)和 Prolia(普罗力,60 mg/ml)。其中Prolia用于治疗骨质疏松,Xgeva用于治疗癌症相关骨病。根据安进财报,Prolia在2022年的全球销售额为36.28亿美元,Xgeva销售额为20.14亿美元。
在中国,原研安进的地舒单抗注射液于2019年首次获批上市,2020年年底通过谈判进入国家医保目录。国内地舒单抗生物类似药,已有博安生物的博优倍于2022年11月获批上市,齐鲁制药、泰康生物、康宁杰瑞也已提交上市申请。
赛诺菲度普利尤单抗新适应症国内报上市
近日,赛诺菲提交的度普利尤单抗注射液(商品名:达必妥?,英文名Dupixent?)新适应症上市申请获得受理,适应症为成人结节性痒疹(Prurigo Nodularis, PN)。此前,CDE已授予该申请优先审评资格。值得注意的是,该药治疗成人结节性痒疹的适应症也曾被美国FDA授予优先审评资格,并已于2022年9月获得FDA批准成为美国首 个专门用于治疗结节性痒疹的药物。
度普利尤单抗是由赛诺菲与再生元合作开发的一款IL-4Rα单抗。2017 年,美国FDA批准Dupixent用于治疗成人重度至重度特应性皮炎,此后又先后获批多项适应症。该药上市首年即实现销售额 2.51 亿美元。2022年销售额达到82.93亿欧元,销售额可突破100亿欧元指日可待。
在中国,度普利尤单抗于2020年6月首次批准用于治疗成人特异性皮炎,商品名为达必妥,目前已进入国内医保目录。2022年2月,度普利尤单抗注射液获得NMPA批准,拓展用于治疗外用药控制不佳或不建议使用外用药的6岁及以上儿童和成人中重度特应性皮炎。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030