https://www.cphi.cn 2023-06-15 09:29 来源:药智网 作者:乖扁豆
国药准字号的字母分类,是药品注册分类最显著的标志之一。
“H”代表化学药,“S”代表生物药,“Z”代表中药…
按最新的《药品管理法》,还有一些特殊的分类,包括“B”、“C”。
“B”代表保健品,一度是中药产品进入医院和医院的障碍,去“B”成为各大药企的诉求。
与“B”天壤之别的是“C”,“C”字是“经典”英文“Classics”的首字母,代表的是经典名方制剂,它的出现,却是代表了光环和前景。
中药3类创新药的
“前世今生”
说起经典名方制剂,不得不说起我国中药注册分类的历史演变。
在旧的注册分类中,经典名方制剂并没有一个特别的类别,分属于“原6.1类中药复方制剂”。
中药复方制剂应在传统医药理论指导下组方,主要包括:来源于古代经典名方的中药复方制剂、主治为证候的中药复方制剂、主治为病证结合的中药复方制剂等。
虽然原注册分类没有把经典名方制剂放在特别的位置,但是2008年的《中药注册管理补充规定》规定:“来源于古代经典名方的中药复方制剂可以不经临床试验直接上市”。
让经典名方制剂成为兵家必争之地。
据药智数据,原6.1类中药累计申报518个,其中报临床401个,报生产117个。
目前已批准251个,批准率为61.1%。
涉及到消化道及代谢、呼吸系统、生殖泌尿系统、骨骼系统等多个疾病领域。
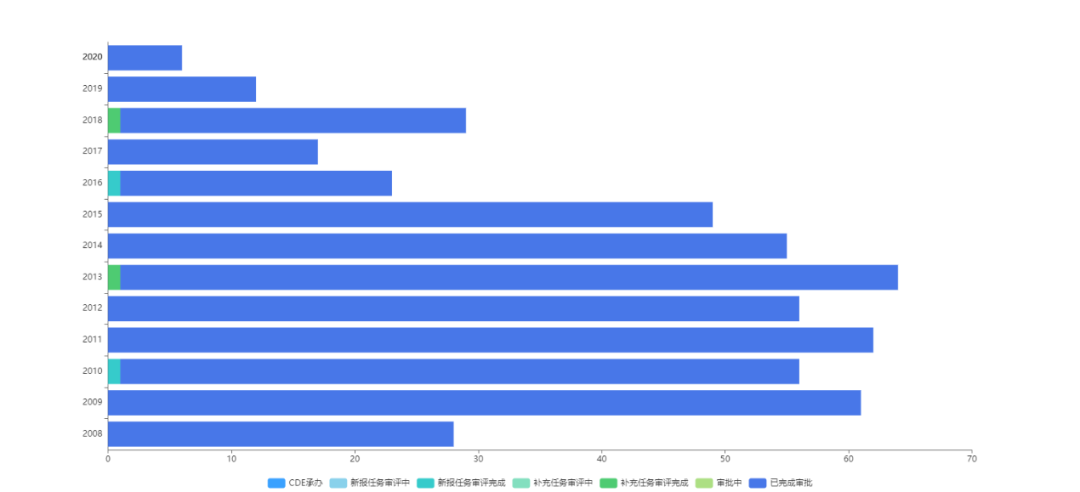
图1 原6.1类中药申报数量分析
数据来源:药智数据
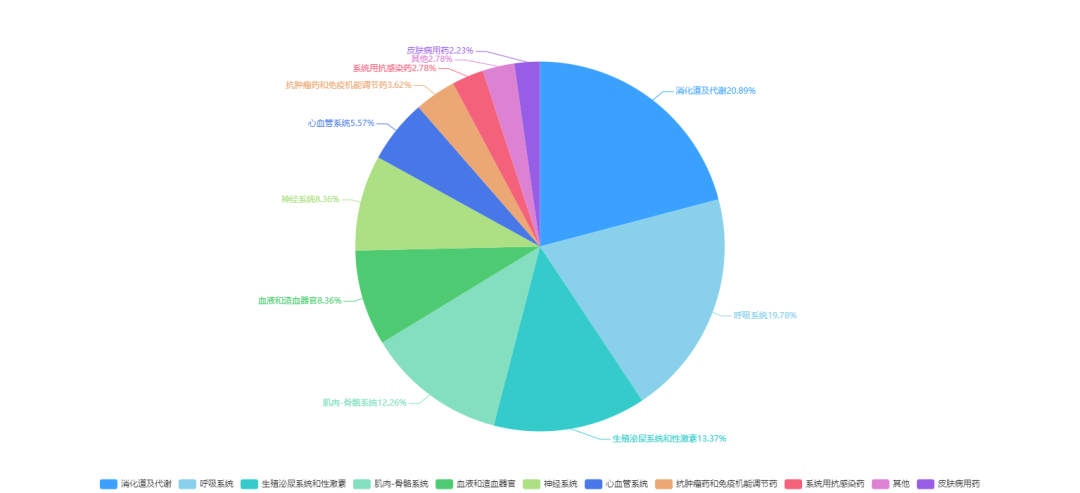
图2 原6.1类中药疾病领域分析
数据来源:药智数据
但是,没有经过临床试验的产品能称之为药品吗?也引发了特别的争议。
面对中药的复杂性,国家药监局在2020年发布了新的《中药注册分类及申报资料要求》,明确中药注册按照中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药等进行分类,前三类均属于中药新药。
按新的注册管理规定,古代经典名方中药复方制剂细分为“3.1按古代经典名方目录管理的中药复方制剂”及“3.2其他来源于古代经典名方的中药复方制剂”。
3.1类的研制,应进行药学及非临床安全性研究;3.2类的研制,除进行药学及非临床安全性研究外,还应对中药人用经验进行系统总结,并对药物临床价值进行评估。
药品批准文号采用专门格式:国药准字C+四位年号+四位顺序号。
《中药注册分类及申报资料要求》要求,在2020年12月31日前,申请人可先按原要求或新要求提交申报资料。自2021年1月1日起,一律按新要求提交申报资料。
2021年8月和10月,国家药监局药审中心分别发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》和《古代经典名方中药复方制剂说明书撰写指导原则(试行)》。
2022年4月,国家药监局药审中心发布《古代经典名方中药复方制剂专家评审委员会委员名单(第一批)》,共由155名中医专家组成,其中包括10名两院院士、19名国医大师和15名全国名中医,将做为技术评审专家对古代经典名方中药复方制剂进行专家技术审评。
2023年02月10日,国家药监局发布了《中药注册管理专门规定》,对古代经典名方中药复方制剂的研制原则和技术要求进行了明确。
自此,经典名方和中药3类新药的顶层设计和注册法规框架基本清晰。
获批情况分析
国药准字C的闪亮登场,既是对过往乱象的洗牌,又作为新风口吸引新的目光。
据药智数据统计,目前获得国药准字C的药品有5款。
有3款是在新冠疫情防控特殊时期优先审评审批的;有2款是2022年新获批的,新获批的2款都出自于康缘药业。
特别是苓桂术甘颗粒,是首 个按古代经典名方目录管理的中药复方制剂获批上市。
苓桂术甘颗粒的上市是深入发掘中医药宝库精华,推进古代经典名方向新药转化的一次生动实践。
表1 国药准字C的批准文号情况
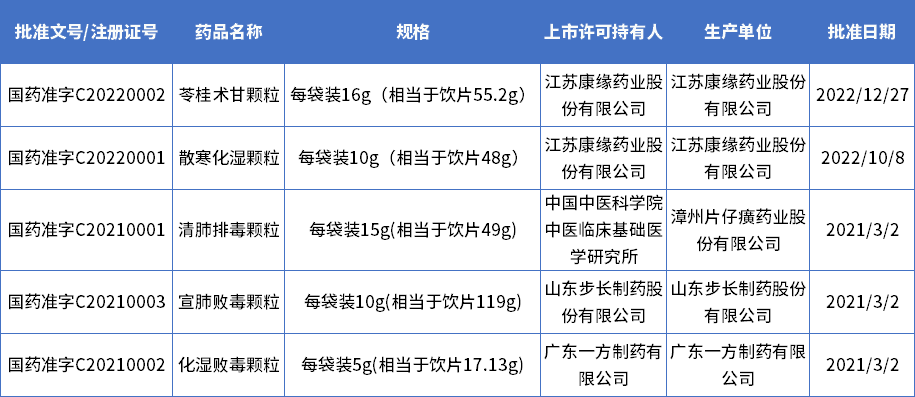
数据来源:药智数据
如果按中药3类新药提交注册和申报的情况分析,根据药智数据,目前累计共有9款产品提交了新药的注册申请,已有2款在2022年获批,另有2款未被批准,在审评审批中的有5款。
表2 中药3类新药注册情况分析
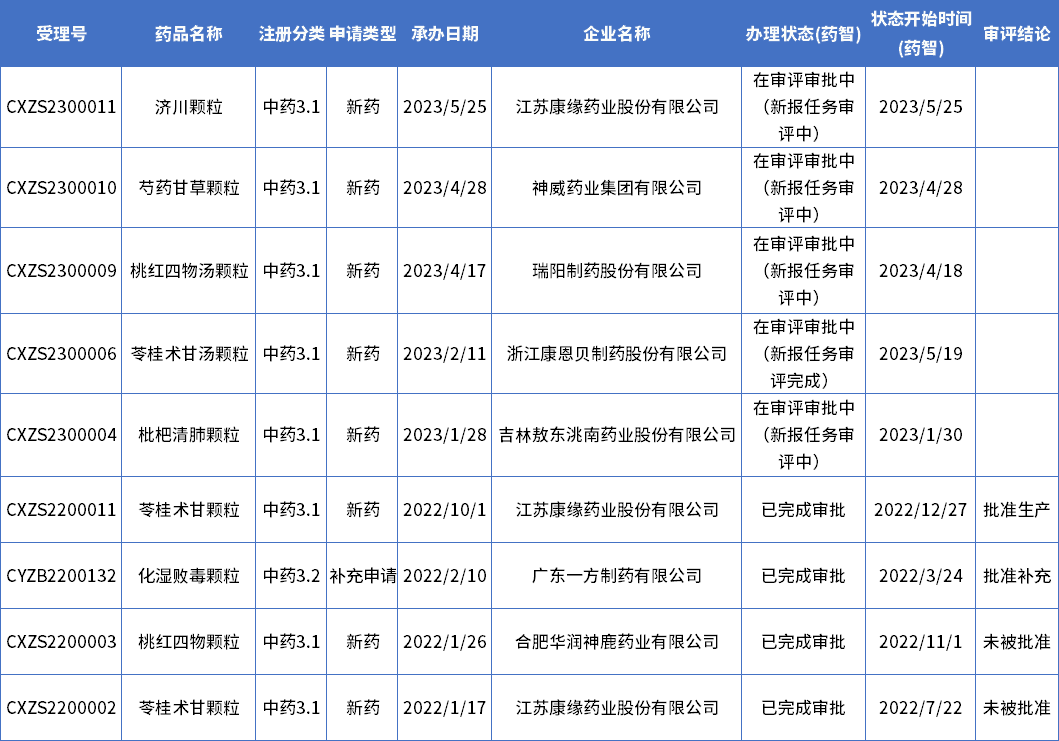
数据来源:药智数据
中药3类新药提交注册和申报的企业中,江苏康缘药业走在前列,共有3款产品,其他几家均只有1款,入局的包括华润神鹿、广东一方、浙江康恩贝、神威药业等几家头部玩家。
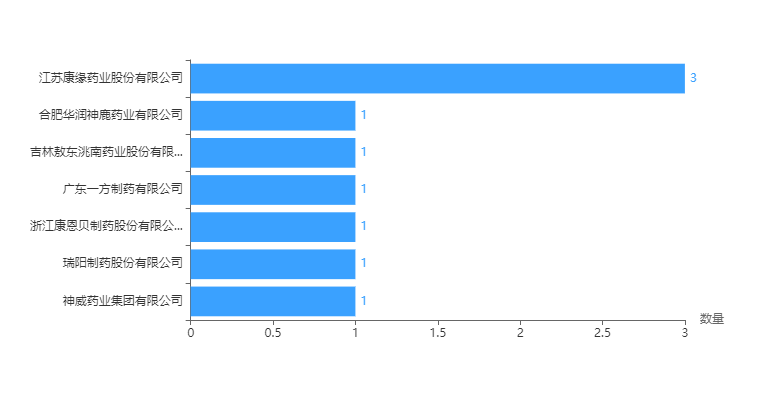
图3 中药3类新药申报企业分析
数据来源:药智数据
从地区分析,基本是集中在东南沿海,作为中药的起源点的“中原地带”,目前还未实现注册申报的突破。
从国家的审评时长,也可以看出国家对经典名方制剂的支持。过去一年多,平均审评时长为148天,不到半年的时间。
与原来6.1类平均受理总时长的616天计算,缩短了75%。
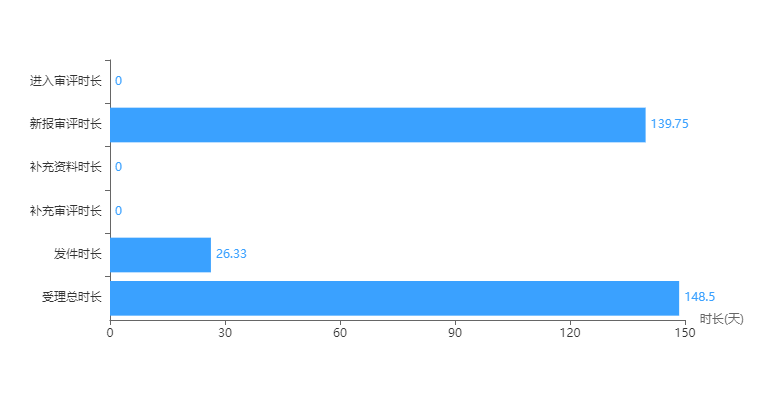
图5 中药3类新药审评平均时长分析
数据来源:药智数据
「国药准字C」能否成为
中药研发的“金 钥匙”?
众所周知,新药在上市前,必须要经过三期临床实验,短的要经历六、七年的时间,长的要10年以上,周期漫长。
而中药三类新药源自于古代经典名方的复方制剂研发,其特点是经过长期的临床实践,安全性、有效性已经得到了较好保障。
得益于国家层面对于加快推动古代经典名方中药复方制剂简化注册审批工作的重视和支持,在不需要进行漫长的三期临床试验,获批上市的时间能够大幅缩短。
当然,研发投入的费用也能够大幅减少,对于日子艰难的企业而言,这无疑是一个重大利好。
但是,经典名方的开发也并非一路坦途,其开发的难点包括:
• 经典名方的考证问题,古书里面记载最早黄帝内经,神农本草经、伤寒论等,每个朝代中药用量可能有所不同,所以考证是个问题,包括度量衡、容量、煎制方法等。
• 标准汤剂的问题,药材、饮片、汤剂三者之间关键质量属性都需要充分研究比对清楚。
• 炮制方法的差异问题,传统方法转化成现代工艺是难题,特别是具有经验特色的炮制方法如何转换为现代的规模化生产工艺。
新药唤醒千亿市场,古法传承创新是关键。如何把握古方特点,让老树开新花,是企业实现弯道超车的关键。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030