https://www.cphi.cn 2024-03-29 15:32 来源:新药创始人
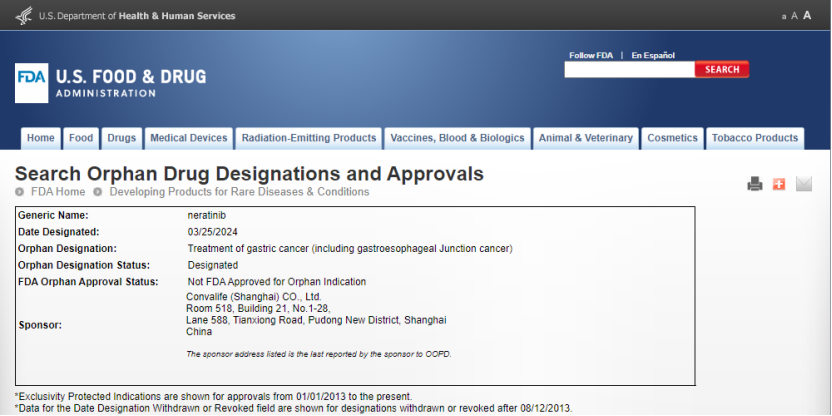
近日,甫康(上海)健康科技有限责任公司(以下简称“甫康药业”)自主研发的CVL009片,获得美国食品药品监督管理局(FDA)孤儿药开发办公室的孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗胃癌(包括胃食管交界处癌)。根据美国FDA《孤儿药法案》,孤儿药资格将享受若干优惠政策,包括FDA对临床研究指导支持、免除NDA申请费用、在美国享受上市申请快速通道,以及批准上市后可获得美国市场的七年独占权等。
中国是全球胃癌发病率最高的国家,我国胃癌新发病例数约占全球的50%,2016年全国新发胃癌患者39.7万例,位列恶性肿瘤新发病例第三位。胃癌患者死亡人数为28.9万例,位列恶性肿瘤死亡人数第三位。胃癌预后差的主要原因是,约90%患者发现时已经属于进展期,即使接受外科手术治疗,5年生存率仍低于30%。HER2阳性患者作为进展期胃癌的特殊群体之一,其精准化治疗研究一直在推进中。2016年,2010年ToGA研究奠定了曲妥珠单抗用于晚期HER-2阳性胃癌的一线治疗地位。沉寂10年后,KEYNOTE-811研究将抗PD-1抑制剂、抗HER-2治疗与化疗相结合, 在治疗HER-2阳性胃癌方面取得了进展,首次中期结果显示联合治疗组的ORR高达74.4%,第2次中期分析中,与曲妥珠单抗联合化疗组相比,帕博利珠单抗联合治疗组获得了PFS时间的显著改善(中位PFS时间为10.0个月∶ 8.1个月,HR = 0.72,95%CI为0.60 ~ 0.87);在PD-L1 CPS ≥ 1的亚组患者中,PFS时间延长了3.6个月(中位PFS时间为10.8个月∶7.2个 月,HR = 0.70,95%CI为0.58 ~ 0.85), 降低疾病进展风险30%。该研究随访至38.5个月时, 帕博利珠单抗联合方案组中位OS时间为20.0个月, 靶向联合化疗组中位OS时间为16.8个月(HR =0.84,95%CI为0.70 ~ 1.01),未达到OS时间显著 延长的主要终点 ;亚组分析中显示PD-L1 CPS < 1的患者帕博利珠单抗联合治疗组的PFS时间与对 照组无差异(中位PFS时间为9.5个月∶ 9.5个月,HR = 1.03,95%CI为0.65 ~ 1.64),OS时间甚至劣于对照组(中位OS时间为16.1个月∶ 22.3个月,HR = 1.61,95%CI为0.98 ~ 2.64)。DESTINYGastric06研究评估了DS-8201单药治疗接受过≥二线治疗的中国HER-2阳性晚期胃癌患者的有效性 和安全性,其中患者ORR为28.8%,中位OS、PFS mDOR时间分别为10.2、5.7、7.9个月 ;整体安全性可控,发生药物相关间质性肺病的患者共3例(3.2%),其中2例为1级,1例为2级。DS-8201有望为我国HER-2阳性晚期患者群体提供更有效的个体化治疗方案。这些HER-2抗体耐药后,患者有望从小分子抗HER2的TKI药物获益。
CVL009是一种强效小分子抗HER2 TKI,属于不可逆的作用于泛HER家族的药物,作用靶点比较广泛,不仅仅可以抗HER2,也可以抑制于HER1和HER 4,从而阻止了 HER家族之间形成二聚体之后的下游传导通道,作用机制更强效。CVL009的临床前研究及大规模临床研究均发现,对于曲妥珠单抗获得性耐药的肿瘤,CVL009的疗效值得肯定。另外TKI药物分子量较小,可以穿过血脑屏障,所以对于脑转移的患者,CVL009也有独特的效果。
关于CVL009
甫康药业研发的CVL009拥有自主专利,为支持该项临床试验申请,甫康药业开展了充分的药学研究和临床前研究。药学研究结果表明,CVL009生产工艺稳定,稳定性良好。已有的临床前研究和临床研究证明了CVL009针对胃癌(包括胃食管交界处癌)有效。此前,甫康药业CVL009已获得了三个2.4类新药的II期注册临床试验IND批件,目前正在开展针对EGFR罕见突变的晚期非小细胞肺癌(NSCLC)患者的临床(CTR20231827),同时即将开展针对胃食管癌脑转移患者靶向药治疗的II期临床试验及针对HER2突变晚期实体瘤患者的II期临床试验。此次甫康药业CVL009获得FDA的孤儿药资格认定,对于加速公司产品在中美的临床项目推进将起到积极的作用。
CVL009治疗胃食管癌脑转移患者的II期临床试验即将在河南省肿瘤医院和南京鼓楼医院等中心开展。胃癌脑转移为胃癌极其严重的病程状态,这部分患者的生存期短,OS只有3个月,并且6个月及12个月因肿瘤而死亡数累计高达57%及71%[1-4]。胃癌脑转移的非手术治疗选择局限,并且无相关指南,迫切需要有效的干预治疗帮助此类患者延长总体生存期。
参考文献
[1] Chen, W., et al., Cancer statistics in China, 2015. CA Cancer J Clin, 2016. 66(2): p. 115-32.
[2] 王鑫, 徐., 我国胃癌诊治临床研究现状与展望. 中华胃肠外科杂志, 2020. 23(2).
[3] Jung, K.W., et al., Cancer Statistics in Korea: Incidence, Mortality, Survival, and Prevalence in 2016. Cancer Res Treat, 2019. 51(2): p. 417-430.
[4] Huang, L., et al., Brain metastasis from gastric adenocarcinoma: A large comprehensive population-based cohort study on risk factors and prognosis. Front Oncol, 2022. 12: p. 897681.
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030