https://www.cphi.cn 2024-04-02 10:32 来源:药渡 作者:哥哈骎
什么是BTD?
A: Breakthrough Therapy Designation(突破性疗法认定,BTD)是FDA(美国食品药品监督管理局)的一种特殊认定,针对的是那些有望显著改善严重疾病治疗的药物或疗法。BTD认定的目的是加速这些潜在疗法的开发和审批过程,以更快地使其可用于患者。
获得BTD需要的标准有几个方面?
A:
证据表明显著改善:提供的临床试验数据必须表明该疗法相对于现有治疗方法在治疗严重病情上具有显著改善。
严重疾病:该疾病必须是严重的,且当前治疗选择有限或不存在。
初步证据支持:申请者需要提供初步的临床数据,表明该疗法的效果。这些数据可以来自早期的临床试验。
紧急性:该疗法必须能够在治疗上提供显著的临床好处,以满足患者的紧急需求。
协调开发计划:申请者需要展示他们有一个协调一致的开发计划,以确保迅速而有效地推进疗法的开发。
获得BTD后,FDA将与药物开发者密切合作,以提供指导和支持,帮助加速疗法的发展和审批过程。这有助于更快地使患者受益于新的治疗方法。需要注意的是,该认定通常是在临床试验的早期阶段获得的,因为在这个阶段FDA认为有必要加速药物的发展。
可想而知,制药公司希望自己开发的产品能够获得FDA的BTD认定,从而加大它们获批的可能,并且加速审批过程。然而2017年1月1日至2019年12月31日的数据显示,肿瘤学之外的药物BTD 申请中,60%都遭到了FDA的拒绝。
CDER(药品评价和研究中心)官员Atasi Poddar等人发表在《治疗创新与监管科学》(Therapeutic Innovation & Regulatory Science)的一篇论文中解释了如此高的拒绝率的背后原因。
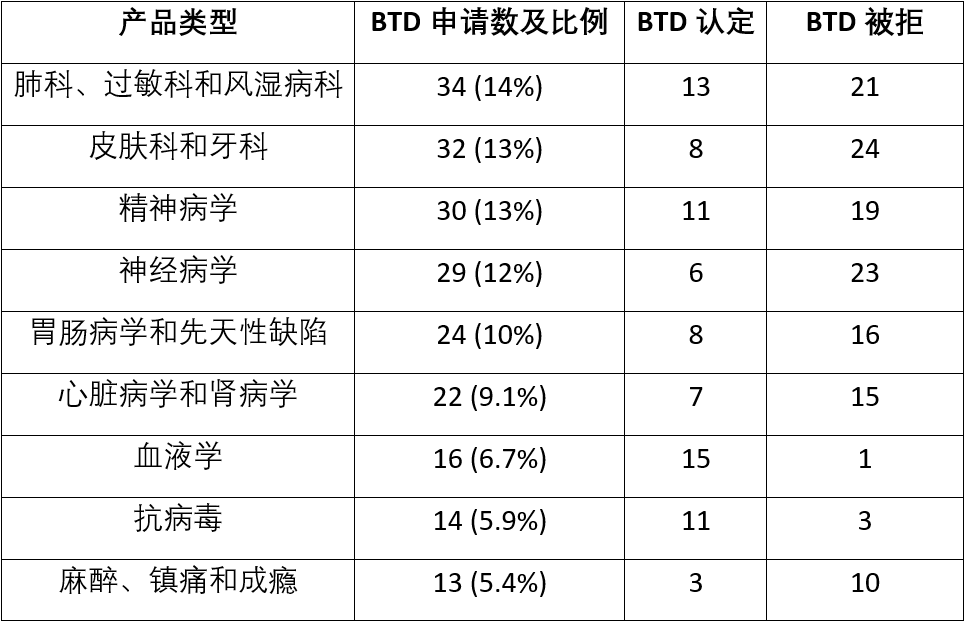
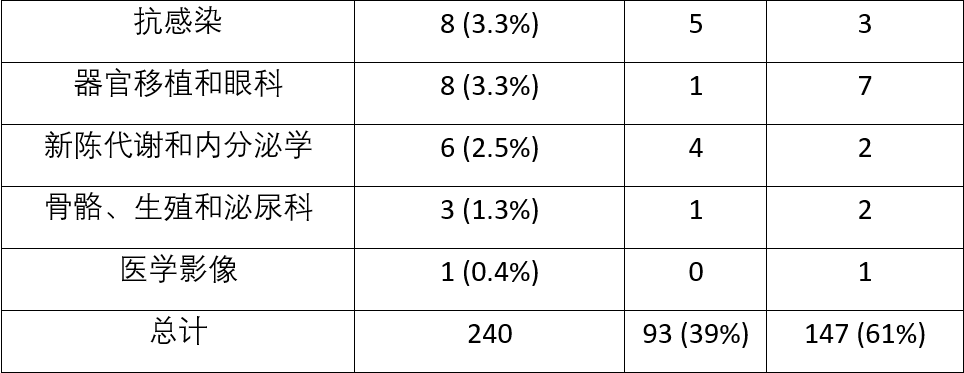
研究发现,在240项BTD请求中,FDA 只批准了93项(39%),超过半数的申请(147项,61%)遭到了FDA的拒绝。截至 2022年底,在28种先前获得BTD 认定并最终获得上市批准的药物中,有21种(75%)涉及First-in-Class(首 创新药)的作用机制。
数据相关问题、治疗效果不足、研究设计不充分、终点属性、安全问题和对后分析(post-hoc analyses)是FDA拒绝BTD请求的最常见原因。
01
BTD申请与适应症关联性
在240项非肿瘤BTD请求中,93项请求(39%)获得批准,147项请求(61%)被拒绝。表1显示了治疗领域的BTD决策总结。
表1.2017-2019年BTD决定和治疗领域
02
BTD申请与疗法存在性的关联性
该分析还包括在BTD申请提交时,FDA 是否批准过相关领域的药物和疗法,参见表2。
表2.BTD决定与相关疗法是否存在之间的关联
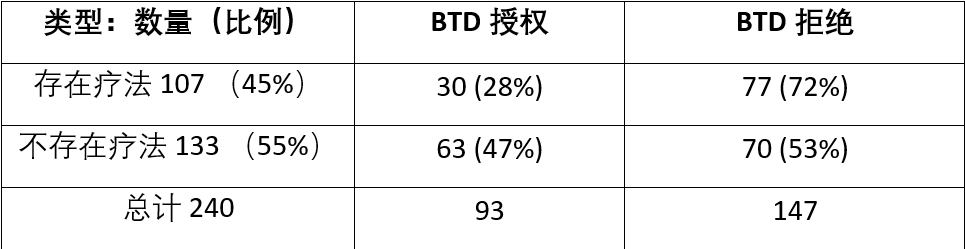
在240项BTD请求中,有107项(45%)在提交BTD时存在相关的疗法,其中30项(28%)获得批准,77项(72%)被拒绝。 在针对尚不存在疗法的133项请求中,有63项(47%)获得批准,70项(53%)被拒绝。
03
BTD获批与孤儿药身份的关联性
从直觉来看,孤儿药似乎更容易获得BTD的认定。事实也的确如此。在240项BTD请求中,90项(42%)涉及孤儿药,其中47项(52%)获得批准,43项(48%)被拒绝。相比之下,在150项(58%)非孤儿药请求中,46项(31%)获得批准,104项(69%)被拒绝。当孤儿药针对的适应症在BTD申请时无获批疗法时,该孤儿药的BTD申请就更容易获得成功。
04
什么BTD申请属性易获得FDA青睐
在对93项批准的BTD申请的进一步分析中,研究者使用了以下四项属性标准,以分析它们获得成功的背后原因:■临床特征
■与现有疗法相比有显著改善的初步临床证据
.撤回BTD请求或撤销已授予的BTD的理由
.上市批准情况
表3. 临床支持的BTD获批申请的阶段
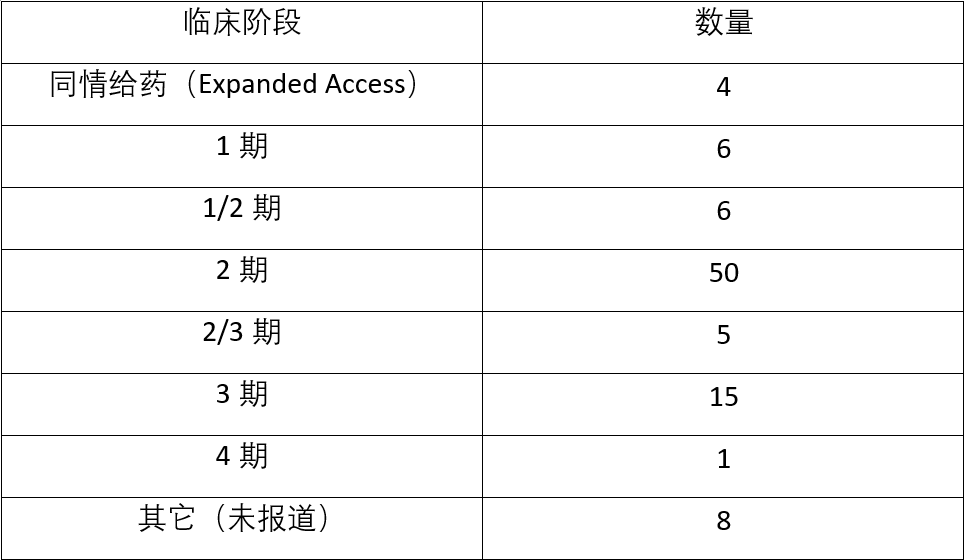
表3显示,93项获得BTD授权的申请中,大多数申请发生在2期(n=50)或3期(n=15)临床。
在这93项批准的BTD请求中,有63项(68%)在申请时市场上没有获批疗法。对于这些请求,CDER批准BTD的决定最常基于重要的临床疗效数据
(n=62)。其中6项申请中,尽管临床疗效相对不算显著,但由于缺乏疗法,仍然被FDA认为疗效具有一定的意义。
在30项(32%)BTD授权时市场上已经有了相关疗法的申请。对于这些请求,CDER在授权BTD的决定会综合考虑以下因素:
.初步证据表明BTD药物有可能比特定适应症的现有疗法有实质性改善(n=20)
■BTD药物的功效与制造商已知已停止的现有疗法相当(n=2)
■BTD药物的安全性得到改善(n=4)■其他(n=4),包括BTD药物适用于对现有疗法没有充分反应的患者。
在93项获得BTD认证的申请中,有60项(65%)的BTD申请中包含了数据显著性的信息,即P-value。其中90%的申请P-value小于5%(有57%的申请P-value小于1%)。在其余10% 报告P-value的成功申请中,尽管重要终点的显著性没有能够获得小于5%的P-value,但它们的关键次要终点具有统计显著性(其主要终点的P-value通常小于10%)。
未报告P-value(n=33)的成功BTD申请最常涉及孤儿疾病。某些研究的受试者人数小于30人(通常小于10人),此类请求通常具有总结级外部对照(通常是在临床研究中用于比较治疗效果的一种方法。在这种方法中,研究人员使用来自独立研究或实际医疗实践中的对照组数据,而不是招募和管理一个新的对照组)。
研究人员在数据分析过程中,注意到了几个可能影响监管机构决策的因素。例如,对于9项已获批准的BTD请求,审查人员指出,其作用机制要么是新颖的,要么是对现有治疗的补充,因此具有联合疗法的潜力。另外,初步证据表明对该药物有持续反应。这个属性是这9项成功申请的背书。这9项涉及到了初步临床证据的请求表明,与现有疗法相比,不仅具有疗效,而且具有提高安全性的潜力,包括减少滥用的可能性。在三个案例中,安全状况的明显改善成为了授予BTD的理由。
05
BTD得而复失的情况
BTD存在被授予又撤销的情况,这在研究中存在8个案例。撤销原因包括:■FDA在授予BTD之后,又批准了其它该适应症的新疗法,导致授予BTD的疗法不再可能显示出比现有疗法有实质性改善的可能性。
■申办者终止药品研发计划的计划。■BTD之后的临床试验的额外数据表明,该药物不太可能比现有疗法表现出实质性改善。
当BTD请求被拒绝时,申办者可以选择提交新请求,提供额外数据。在获得批准的93项BTD请求中,有8项(9%)是在被拒之后通过新提交的申请,包含修改后的适应症或附加数据,并最终获得成功的。
有三项BTD申请在获得后被赞助商撤回。其中一项是在FDA对后续安全数据表示出担忧之后,申办者撤回的。另外两项是申办者根据FDA的建议撤回的。在获得BTD认定的93项申请中,有10中最终没有保留住这个头衔。
06
获得BTD后的上市情况
截至2022年12月31日,2017年至2019年期间获得BTD批准的29款药物最终获得了FDA的监管批准,催生了28款药物的上市。值得注意的是,有11种药物的NDA(新药生产上市注册申请)/BLA(生物制品许可申请)获批,是在获得BTD头衔一年内实现的。这表明一些BTD头衔的授予是在药物开发周期较晚的阶段做出的,这一点对应了表3中的数据。这获批的28种药物中有21种(75%)是同类药物中的首 创,也表明了这些药物具有与现有疗法不同的作用机制,支持了它们获得BTD的资格。
07
BTD申请被拒的教训
该研究内容包括了61项不经审查直接被拒绝授予BTD的申请(42%)。它们都具有明显的不符合BTD授予资格的特征。例如,适应症不是严重或危及生命的疾病,参加试验的参与者不针对BTD相关患者群体,或者缺乏对现有疗法的潜在改善的证明。
有86项BTD申请经过申请但遭拒,其中有26项(30%)给出了单一拒绝理由。在剩下的60个(70%)被拒申请中,被拒原因超过一条。其中治疗效果不足是最常见的拒绝原因(n=50;58%)(表4)。
表4. BTD申请失败原因及数据
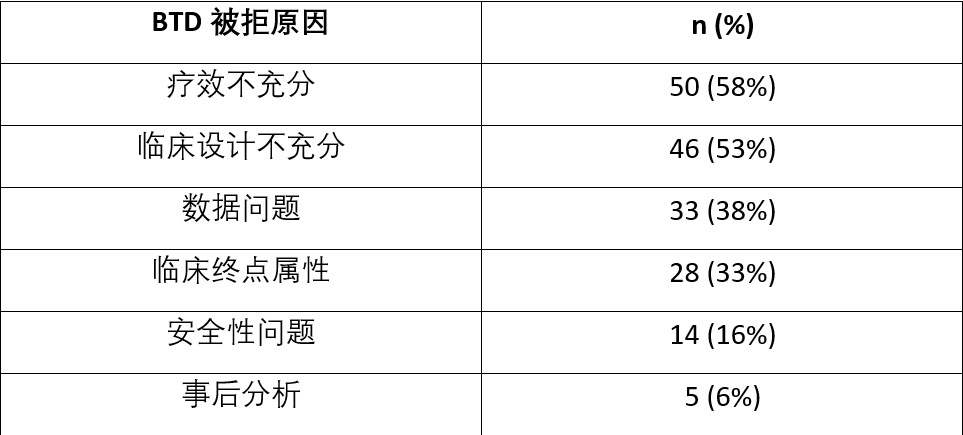
排在第二的拒绝原因是试验设计缺陷,包括研究时间短导致难以评估实质性益处的初步证据、缺乏适当的控制臂、依赖次要终点时的多重性问题(多重性问题是指当进行多个统计检验或比较时,由于纯粹的随机性,可能会出现虚假的显著性结果)、外部对照组与单臂试验中的患者匹配不佳等。
33 个(38%)被拒绝的 BTD 申请是由数据相关问题所导致的。包括缺乏试验参与者的治疗前史、改善的时间与预期的药物机制不一致,或者比较组的数据不足。
临床终点与患有该疾病的患者没有临床相关性,也是FDA拒绝授予BTD的原因之一。包括缺乏支持性证据表明申请者使用的终点对应了临床上有意义的益处,或者临床终点并不对应疾病的严重方面。
14项(16%)请求中,安全性成为了拒绝理由。包括研究组与对照组相比不良事件过多。有缺陷的事后分析也成为了5项被拒申请的理由。
结语
BTD头衔能够为药物开发商提供多项好处,包括增加与FDA会面的频率、加强药物开发过程中的沟通、滚动审查的资格等。BTD有助于加速新药物的研发和上市,提高疗效标准,同时也为药物开发者和投资者提供了更多的机会。
申请者在为自己的药物候选物申请BTD 的过程中,应该注意提供初步证据、证明对严重疾病的改善、沟通与FDA的合作、证明紧急性、提供完整的申请材料、准备好回应FDA的反馈。同时需要注意以下陷阱:
.不足的初步证据:申请者需要提供初步的临床试验数据,以证明新药在治疗特定疾病方面具有显著的疗效。如果提供的证据不足以支持这一点,可能会导致BTD申请的拒绝。
■缺乏紧急性的证明:BTD通常要求证明患者需要迅速获得新疗法,因为目前的治疗选择有限或不存在。如果未能清晰地表达药物的紧急性和对患者的重要性,也可能导致申请被拒绝。■不合适的沟通:与FDA的密切合作对于获得BTD至关重要。不充分的沟通或未能积极回应FDA的反馈可能导致审批流程的延误或失败。
■试验设计问题:临床试验的设计对于BTD的申请至关重要。如果试验设计不够强大、缺乏临床意义,或者未能充分展示药物的潜在疗效,可能会遇到问题。
■数据质量和完整性问题:提供的数据必须是准确、完整的,并符合FDA的质量标准。数据质量不佳或者存在数据缺失可能影响BTD的审批。
■伦理问题:在试验中必须遵循伦理原
则,确保患者的权益得到充分保护。违反伦理规范可能导致BTD的申请失败。
■未充分解释药物机制:未能清晰解释药物的药理学和机制可能影响FDA对药物的理解和认可。清晰而详尽的机制解释有助于建立药物的科学基础。■不考虑多重性问题:如果在申请中依赖于多个次要终点,应该注意多重性问题。合理规划统计分析,防范多重比较问题。
■未能证明药物的新颖性:BTD通常更容易授予给那些具有创新性的药物。如果未能充分证明药物的新颖性和与现有治疗方式的区别,可能会影响BTD的申请。
在整个BTD申请过程中,与FDA的沟通是至关重要的。避免这些陷阱的关键是在整个研发过程中保持透明度、及时沟通,以确保申请符合FDA的标准和期望。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030