https://www.cphi.cn 2024-04-24 09:37 来源:药渡 作者:樊凤辉
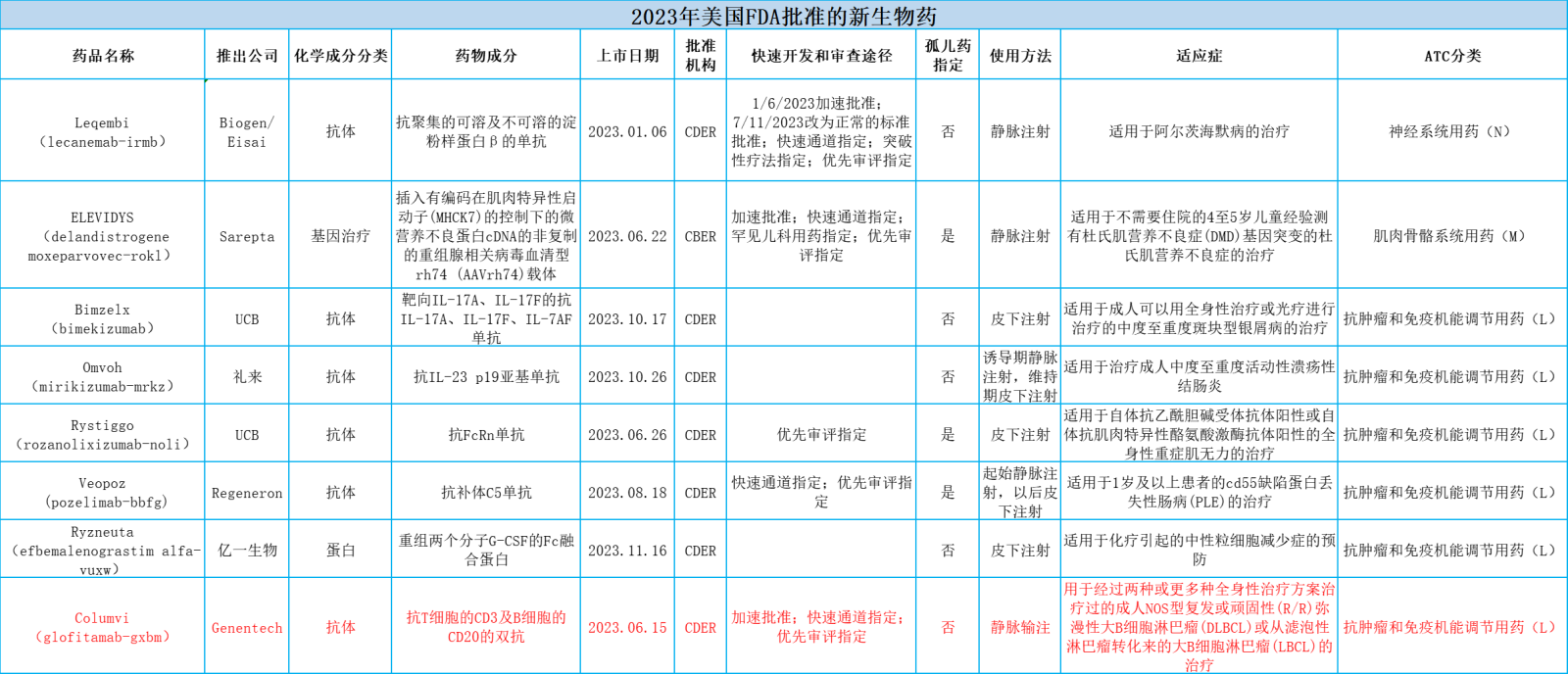
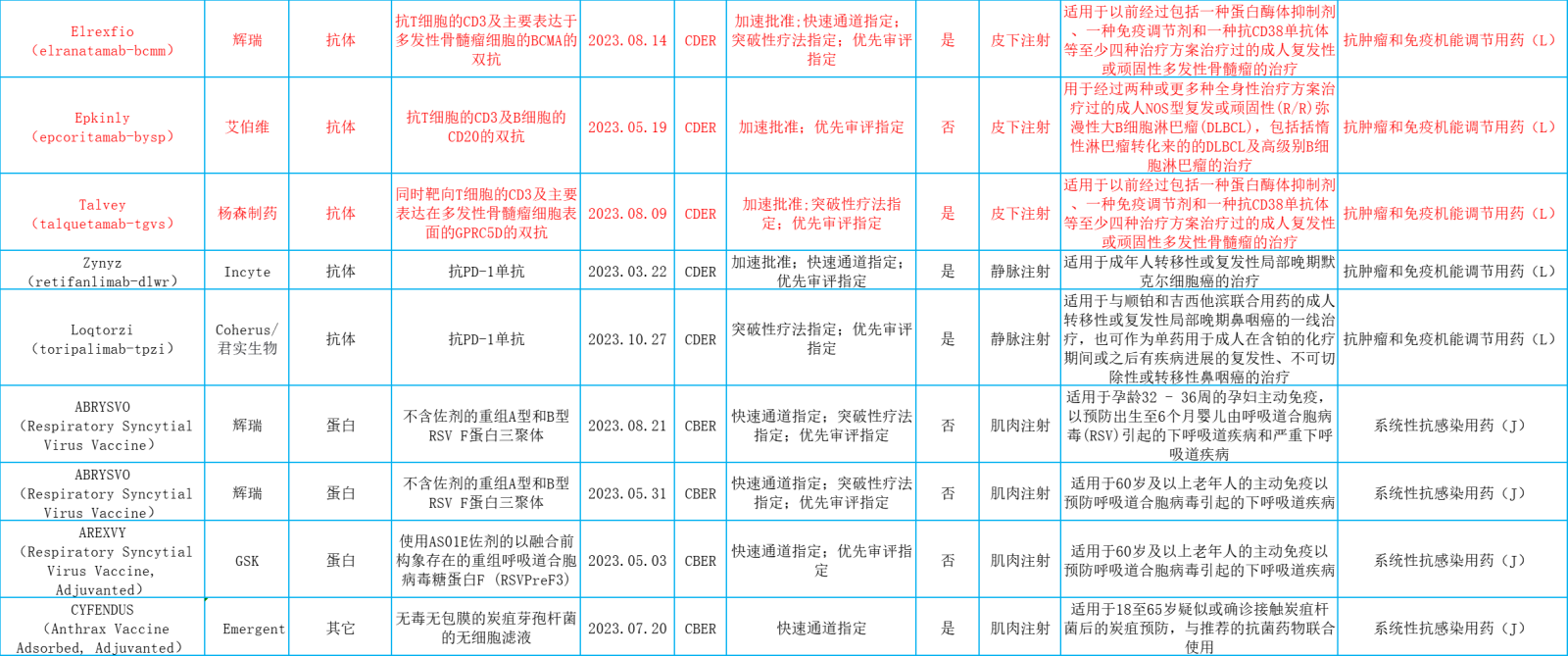
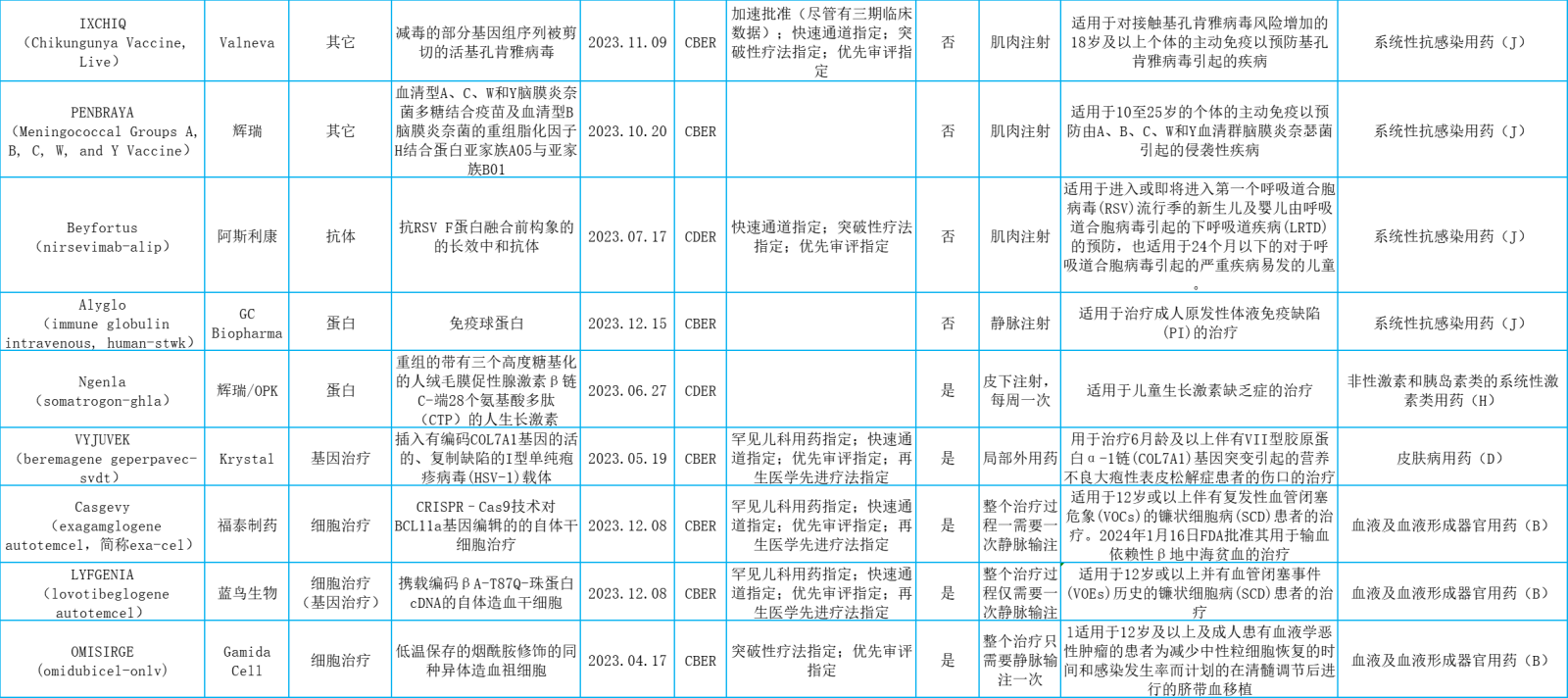
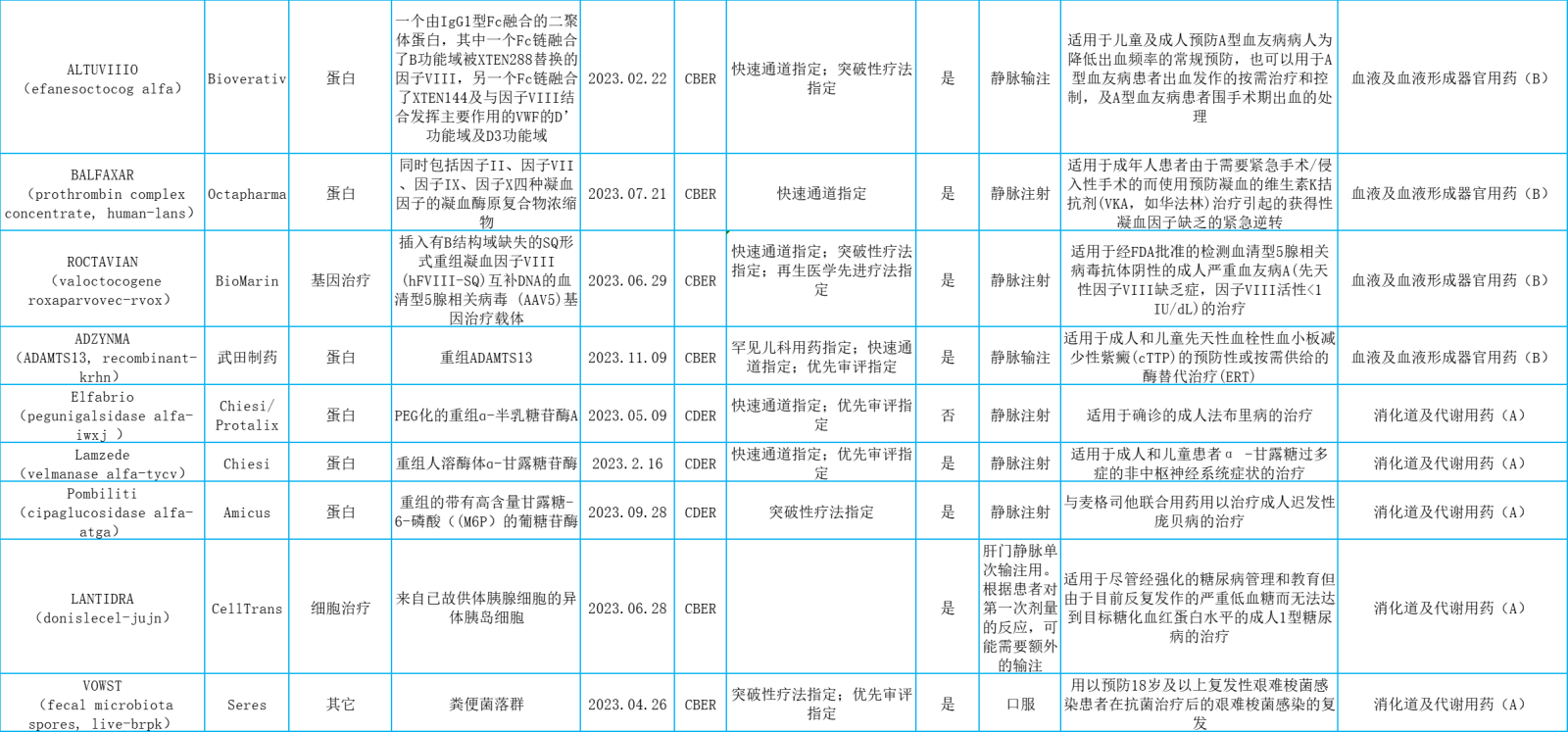
美国FDA下属的药品评价与研究中心(CDER)2023年批准的55个新药中共有17个新的生物药,美国FDA下属的生物制品评价及研究中心(CBER)2023年批准的25个生物制品中共有18个新的生物药。
这35个新生物药按解剖学治疗学及化学(ATC)分类,则包括抗肿瘤和免疫机能调节用药,系统性抗感染用药,血液及血液形成器官用药,消化道及代谢用药,皮肤病用药,非性激素和胰岛素类的系统性激素类用药,肌肉骨骼系统用药和神经系统用药。
本文将主要从抗肿瘤和免疫机能调节用药(11个占31.4%)、皮肤病用药(1个占2.9%)、非性激素和胰岛素类的系统性激素类用药(1个占2.9%)和神经系统用药(1个占2.9%)进行介绍。想要了解《2023年美国FDA批准的新生物药概览》完整表格,请看文末。
6个抗肿瘤药及其创新点如下
1.杨森制药公司的Talvey是被CDER认定的first-in-class的首 创药。它是一种同时靶向多发性骨髓瘤细胞表面的GPRC5D 及T细胞表面的CD3的双抗。这样它可以将骨髓瘤细胞与T细胞结合在一起,利用T 细胞杀死骨髓瘤细胞。
一般将这样的双抗称为动用T细胞的双抗,它杀死肿瘤细胞的机制类似于CAR-T,但其优点是,它并不是一个活细胞药物,而是一个可以现货供应的抗体类药物。
Talvey是一个方便病人使用的皮下注射制剂,用于以前经过多种治疗方案治疗过的复发或顽固性多发性骨髓瘤的治疗。Talvey也是一个全球范围内在美国首先获批上市的药物。
2.辉瑞公司的Elrexfio是一个同时靶向多发性骨髓瘤细胞表面的BCMA及T细胞表面的CD3的动用T细胞的双抗,它是全球范围内首 个获批的货架型皮下注射用固定剂量的靶向BCMA的药物,并可在使用24周后实现两周一次给药。
Elrexfio是一个方便病人使用的皮下注射制剂,适用于以前经过包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38单抗体等至少四种治疗方案治疗过的成人复发性或顽固性多发性骨髓瘤的治疗。
3.艾伯维公司的Epkinly是一个同时靶向T 细胞的CD3及B细胞的CD20的双抗。是全球范围内首 个获批的动用T细胞的治疗复发性或难治性弥漫性大B细胞淋巴瘤的双抗,为方便病人使用的皮下注射制剂。
4.Genentech公司的Columvi也是一个同时靶向T细胞的CD3及B细胞的CD20的双抗。一个分子Columvi可以结合B细胞上的两个CD20及T细胞上的一个CD3epsilon。
静脉注射,每个疗程21天,第一疗程即剂量抬高阶段,治疗后每三周给药一次,最多允许使用12个疗程(治疗过程中发生疾病进展或严重的毒性事件则可以在完成12个疗程的治疗前停止治疗)。
这是第一个也是唯一一个治疗时间固定的治疗成人复发性或难治性弥漫性大B细胞淋巴瘤的动用T细胞的双抗药物。
5.Incyte公司的Zynyz是一个治疗转移性或复发性局部晚期默克尔细胞癌(MCC)患者的一线抗PD-1单抗药物,在全球范围内首先在美国获批上市。其它的治疗转移性或复发性局部晚期默克尔细胞癌的一线治疗药物包括抗PD-L1单抗Avelumab及抗PD-1单抗Pembrolizumab等。
6.Coherus公司和君实生物的Loqtorzi是一个靶向PD-1的单抗药物,它也是FDA 批准的首 个用于鼻咽癌患者的药物。君实生物的同个产品特瑞普利单抗((商品名拓益)于2018年在中国上市用以治疗既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗。
4个免疫抑制剂及其创新点如下
1.Regeneron公司的Veopoz是一个被CDER认定的first-in-class首 创药。它是一种靶向补体C5的单抗,是全球范围内首 个也是唯一一个获批的专门用于治疗CHAPLE的药物。
2.UCB公司的Bimzelx是一个同时靶向IL-17A和IL-17F的抗IL-17A、IL-17F、IL-7AF的单抗。它是第一个也是唯一被批准的同时抑制与炎症有关的IL-17A、IL-17F、IL-7AF三种细胞因子的银屑病治疗药物。
3.礼来公司的Omvoh是一个靶向IL-23p19亚基的单抗。它是第一个也是唯一一个靶向IL-23 p19亚基的用于治疗成人中度至重度活动性溃疡性结肠炎的药物。
4.UCB公司的Rystiggo是一个靶向FcRn 从而可以缩短体内抗体半衰期的单抗,全球范围内在美国首先上市。这是FDA批准的唯一一个即治疗自体抗乙酰胆碱受体抗体阳性的全身性重症肌无力,又治疗自体抗肌肉特异性酪氨酸激酶抗体阳性的全身性重症肌无力的药物。
1个免疫促进剂
1个免疫促进剂即亿一生物的Ryzneuta。它的创新点是它为一个带有两个G-CSF的Fc融合蛋白。它的获批上市为中性粒细胞减少症患者提供了一种治疗选择。
1个皮肤病用生物药
美国FDA 2023年批准的1个皮肤病用生物药为Krystal公司的VYJUVEK。营养不良大疱性表皮松解症是由编码VII型胶原蛋白的COL7A1基因突变引起的,VII型胶原蛋白是真皮﹣表皮粘合的锚定原纤维的主要成分。
创新之处在于,VYJUVEK是一种活的、复制缺陷的I型单纯疱疹病毒(HSV-1)载体基因疗法,它编码COL7A1基因,可以使营养不良大疱性表皮松解症患者的VII型胶原蛋白水平恢复。
VYJUVEK是第一个可重复给药的局部用药基因疗法,是FDA批准的第一种也是唯一一种由医疗保健专业人员在医疗保健专业环境中或在家中给药的用于治疗隐性和显性营养不良大疱性表皮松解症的药物。适用于治疗6月龄及以上伴有COL7A1基因突变引起的营养不良大疱性表皮松解症患者的伤口的治疗。
Krystal公司为此获得过美国FDA的罕见儿科用药指定的药物的研发,成功获得了一张FDA可以用于其它药物优先审评指定的优先审评券。
1个非性激素和胰岛素类的系统性激素类生物药
美国FDA 2023年批准的1个非性激素和胰岛素类的系统性激素类生物药为辉瑞及OPKO公司的Ngenla。
创新之处在于,其活性成分为重组的带有三个高度糖基化的人绒毛膜促性腺激素B 链C﹣端28个氨基酸多肽(CTP)的人生长 激素。
Ngenla是一种重要的长效人生长 激素治疗选择,有助于提高生长 激素缺乏症儿童的治疗依从性。Ngenla已在包括加拿大、澳大利亚、日本和欧盟成员国在内的40多个市场获批上市,用于儿童生长 激素缺乏的治疗。
1个神经系统用药
美国FDA 2023年批准的1个神经系统用药为渤健公司和卫材公司的Leqembi。
创新之处在于,它是抗可溶及不可溶的聚集淀粉样蛋白B的单抗。它是全球范围内首 个也是唯一一个被批准的可以降低成人阿尔茨海默病(AD)患者的疾病进展速度并减缓其认知和功能衰退的药物。
该药物于2013年1月6日被FDA以加速批准的方式批准上市。2023年7月6日被FDA以传统方式批准上市。
2023年美国FDA批准的新生物药中最抢眼的无疑是Talvey、Elrexfio、Epkinly、Columvi四个治疗血液瘤的动用T细胞的双抗。在与治疗同样适应症的CAR-T的竞争中,这四个双抗都是现货型药物且容易产业化,且不具有像CAR-T那样高的细胞因子释放综合征毒性及神经毒性。这四个双抗中的三个采用了病人容易接受的皮下注射给药制剂,一个明显的信号是,病人使用这样的药物并不需要严格的住院。
2023年美国FDA没有批准任何一个CAR-T药物及治疗癌症的ADC药物。加上2022年美国FDA批准的两个治疗癌症的动用T细胞的双抗药物,双抗药物、ADC药物、及以CAR-T为代表的细胞治疗药物正在形成癌症治疗药物的三驾马车。
2023年美国FDA共批准了Veopoz、Bimzelx、Omvoh、Rystiggo四个免疫抑制剂生物药,维持了自体免疫领域的生物药一直是美国FDA历年生物药批准的重头戏这一传统。
呼吸道合胞病毒感染相关药物在2023年有了井喷式的进展,美国FDA共批准了包括预防用单抗Beyfortus、带佐剂的疫苗AREXVY、不带佐剂的60岁及以上老年人主动免疫用疫苗ABRYSVO、不带佐剂的孕妇注射但用于新生儿免疫的主动免疫用疫苗ABRYSVO共四个。
抗出血的生物药方面,2023年美国FDA批准了三个新生物药,包含一个治疗严重A型血友病的基因治疗药物ROCTAVIAN和一个用于预防A型血友病病人出血时可以每周给药一次的长效因子VIII药物ALTUVIIIO。
镰状细胞病治疗方面,Casgevy和LYFGENIA两个细胞治疗药物的推出为这一疾病的终生解决提供了方案,其中Casgevy是第一个在美国获得批准的基于CRISPR的基因编辑疗法。
细胞治疗方面的另一项突破是,OMISIRGE采用了可以扩增的异体造血祖细胞技术,势必会将会拓展造血干细胞移植的应用。
2023年美国FDA批准了Lamzede、Elfabrio、Pombiliti三个治疗代谢性疾病的重组蛋白酶,而治疗代谢性疾病的重组蛋白酶也是最近几年FDA批准新药的一个重点。
2023年美国FDA批准的另一个值得特别关注的药物是用于阿尔茨海默病治疗的Leqembi。
尽管LYFGENIA获得过美国FDA的罕见儿科用药指定,蓝鸟公司并没有能够因为LYFGENIA的研发成功而获得可以用于其它药物优先审评指定的优先审评券,FDA解释是因为LYFGENIA与2022年批准的蓝鸟公司治疗β地中海贫血的Zyntegl具有相同的活性成分。
从药物的化学成分来看,2023年美国FDA共批准的35个新生物药中包括12个抗体药物,12个蛋白类药物,4个细胞治疗药物,3个基因治疗药物,1个口服粪便微生物菌落群药物,1个减活病毒疫苗,1个由过去上市的多糖结合疫苗和过去上市的重组蛋白疫苗结合的疫苗, 及1个源自于无毒无包膜的炭疽芽孢杆菌的无细胞滤液的疫苗。
在贡献2023年美国FDA批准的新药的数量方面,名列三甲的是,推出了5个的辉瑞公司,推出了2个的UCB公司以及推出了2个的Chiesi公司。另外,中国的亿一生物公司和君实生物共贡献了两个2023年美国FDA批准的新生物药。
在采用美国FDA的快速开发和审查途径方面,2023年美国FDA批准的35个新生物药中:有21个获得了可以提高FDA和药物开发公司之间的沟通水平,及允许FDA对药物申请的部分内容进行滚动审批以加快新药和生物制剂的开发和审批速度为目的的快速通道(Fast Track)指定,占60%;13个获得了包括快速通道途径项目的所有特点并在药物开发过程中可以提供强化的FDA指导的突破性疗法(Breakthrough Therapy)指定,占 37.1%;23个由于被确定药物可以治疗严重的疾病,且如果批准该药物将显著改善治疗、诊断或预防该严重疾病的安全性或有效性,而获得了旨在提交申请的6个月内而不是标准申请的10个月内FDA采取行动的优先审评(Priority Review)指定,占65.7%;8个采用了使用替代终点或中间临床终点的加速审批(Accelerated Approval)途径,占22.9%,也意味这8个新药上市后FDA仍可能会要求提供药物的临床获益数据。
2023年美国FDA批准的35个新生物药中有4个获得了适用于细胞治疗、治疗性组织工程产品、人体细胞和组织产品等的再生医学先进疗法指定 ,占11.4%。
2023年美国FDA批准的35个新生物药中有21个获得了可以使研发公司获得经济利益的孤儿药指定,占60.0%;5个获得了罕见儿科用药指定(占14.3%), 其中的4个推出公司由于罕见小儿疾病用药的贡献获得了可以用于直接获得其它药物优先审评指定的优先审评券。
表.2023年美国FDA批准的新生物药概览
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030