https://www.cphi.cn 2024-04-08 10:10 来源:CPHI制药在线 作者:Krebs Qin
加速批准是每个申请者都渴望获得的特权。你不仅可以以更快的速度率先上市,还可以凭借替代终点实现这一目标而暂时无需费时费力地获取常规终点的数据。上市之后就意味着可以开始收回研发投资,无论这款药物是否真的有效安全。至于何时递交上市后验证性研究数据,你只需要向FDA做出个时间上的承诺,然后就可以不急不徐地一边上市赚着钱,一边做出收集数据状给FDA看。如果超时怎么办?你可以申请延期接着干。毕竟这款药物可能已经拥有了广大的患者群体,尤其是那些没有其它选择的适应症,FDA很可能会因为投鼠忌器而进退维谷、左右为难。例如癌症药物 Folotyn (Pralatrexate)在15年前就已经获得了FDA的加速批准,用于治疗复发或难治性外周 T 细胞淋巴瘤 (PTCL),但15年后FDA仍然没有获得确凿的证据表明这款昂贵药物的有效性。更有甚者,在上市后的进程中,Folotyn已经数易其主,但数据仍然悬而未决。而且它的前任和现任所有者已经将上市后研究的最后期限至少推迟了10次。据 GoodRx 称,Folotyn 每年的费用约为 90 万美元,自 2022 年 1 月以来,该药物已四次提价。而且这种例子在美国俯仰皆是。
但那是以前的老光景了。FDA醒了。
2022 年 12 月 29 日,美国总统拜登签署了《2023 年综合拨款法案》(Consolidated Appropriations Act, 2023),其中包含《食品和药品综合改革法案》(FDORA,Food and Drug Omnibus Reform Act)。在面对一些开发商上市后验证性研究中采取的"卧草"拖延时间的伎俩时,新颁布的FDORA法令有两项内容值得关注。一是允许FDA要求制药商在获取加速批准的同时就已经开展验证性研究,否则FDA将有权力对该项申请不予批准,即便数据完 美。再生元就成为了这条规定的首位"试法者"。2024年3月25日,再生元的CD20xCD3双特异性抗体odronextamab针对复发/难治性滤泡性淋巴瘤(FL)和复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)的两项申请均遭到了FDA的拒绝。FDA的完整回复函里强调的问题,既不是有效性和安全性,也不是临床设计,抑或CMC,而是odronextamab的验证性试验的时间表没有证明验证性研究在其sBLA申请的同时"正在进行"。再生元收到的这份CRL,可能是FDA历史上首次因为"上市后研究时间表问题"而颁发的,这个现象明确地释放出了FDA紧缩加速批准监管政策的信号,也验证了体现了FDA肿瘤学卓越中心主任 Richard Pazdur 此前的承诺,即在加速批准之前对新抗癌药物的验证性试验要求采取更强硬的立场。
FDORA授予FDA的第二大权柄就是简化撤回程序,可以不召开公开听证会而直接撤回批准。在这方面的第一个试法者是Oncopeptides的多发性骨髓瘤药物 Pepaxto(Melphalan flufenamide)。Pepaxto在2021年2月26日获得FDA加速批准。在验证新试验出炉之后,FDA于2022年9月在咨询委员会会议上投票(14:2)反对该药物的获益风险概况。FDA在2023年7月提议Oncopeptides在美国撤回其药品。8月,Oncopeptides对 FDA 的快速撤回提案提出了上诉。2024年2月,FDA正式撤回了对于Pepaxto的加速审批决定。从提议撤回到正式撤回,FDA使用了7个月的时间,从而创造了撤回加速批准的最快纪录。Pepaxto的特殊性,在于它是FDA使用FDORA赋予他们的新权力而撤销监管批准的第一个例子。体现在撤回是在不召开听证会的情况下"截弯取直"直接做出的。加速批准的撤回近年来出现了"来也匆匆,去也匆匆"的势头(图1),在得到了FDORA的加持后,加速批准项目"朝如青丝暮成雪"的现象有可能成为常态。
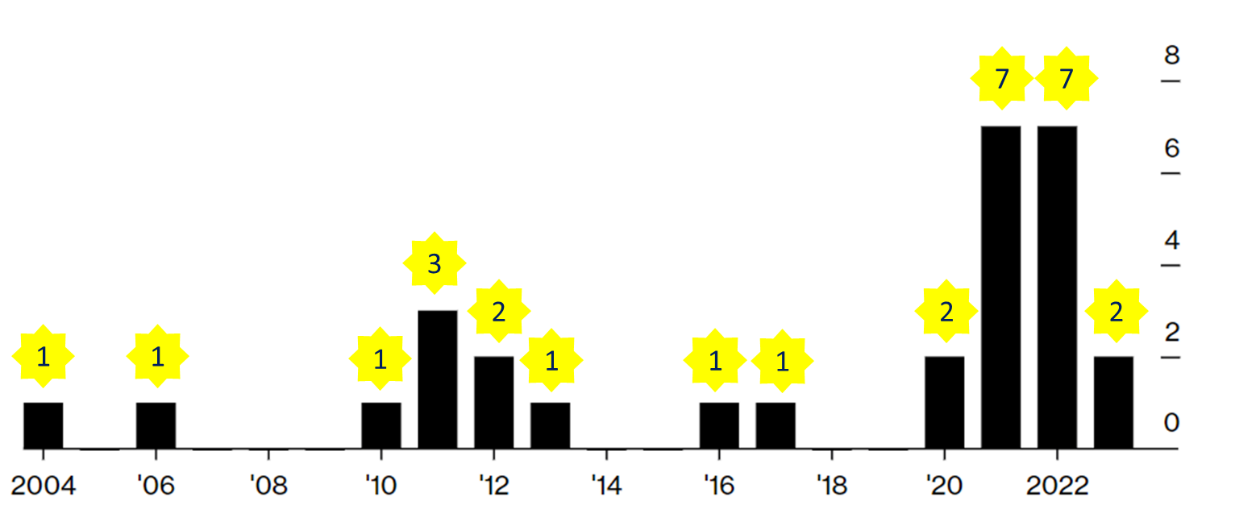
图1. 加速批准药物退市年份分布(数据来源:Bloomberg)。注:计数包括完全退出市场的药物和留在市场上用于其他用途的部分退出药物。具有多个批准的药物,在不同年份撤回的情况,每年计算一次。
FDA今年对于加速审批的两次铁腕监管行动,显示出以往对加速批准"优柔寡断"的FDA "现在好了,我能小跑儿了,我还能垫步"。
那么对于希望继续走加速批准道路的开发商来说,面对觉醒的FDA,应该如何谨言慎行,走同加速批准的道路,而不至于穷途而哭呢?
以史为鉴啊!
• 保证确认性试验完成
加速批准药物被褫夺的主要原因之一是验证性试验未完成。加速批准是一种有条件的监管决定,最重要的就是通过上市后的验证性研究证明获批产品的安全性和/或有效性。
根据 2021 年的一项研究,那些在加速批准时已经有确认性试验中期分析数据的药物,更有可能最终获得完整批准。生物制药开发商现在需要考虑如何优化规划和资源分配来完成验证性试验,而且FDORA要求在获得加速批准的同时就要证明验证性"正在进行中"。尽管这个"正在进行中"的理解可能还有一些自由空间,但不审势即宽严皆误,再生元的odronextamab就是最新教材。
• 评估总体生存期
业界对加速批准的一个主要诟病在于替代终点的使用,而不是明心见性地直指核心终点,即那些具有临床意义且以患者为核心的表征指数。以加速批准最为盛行的肿瘤学领域为例,很多加速批准是凭借缓解率或无进展生存期为替代终点而实现弯道超车的终南捷径的,而并非具有明确临床意义的总体生存期OS。获得加速批准的药物中有 87% 是基于缓解率为终点上市的。
虽然使用替代终点正是加速批准之所以成为加速批准的关键点之一,但在上市后验证性研究中仍然"抱残守缺"地使用同样的终点,试图将加速批转升级为完全批准,这就会产生问题。由于替代终点可能会与客观临床获益缺乏相关性而产生脱钩,FDA很可能会对上市后研究无视总体生存期的做法感到不适。而实际上也的确只有 20% 的验证性试验使用总体生存期作为研究终点,这给FDA一种"知我者,谓我心忧;不知我者,为我何求"的无奈感觉。
当临床适当且逻辑上可行时,生物制药创新者应考虑为加速批准之后的验证性试验提供总体生存期的数据。
• 改进研究设计
加速批准有时可能是基于单臂研究,这一点得到数据的印证:自1992年推出加速批准政策出台以来,大约 72% 的加速批准依靠的是单臂研究。很显然,单臂研究缺少对照臂,这可能会给临床意义的解读造成困难。
除此之外,使用单臂数据可能导致对益处的估计不足。由于缺乏对照组的比较,因此很难确定治疗的真实效果。在这种情况下,成本效益分析往往依赖于模型。
由于某些疾病的罕见性以及相关策略的适用性,可以通过增加随机试验的使用、避免单臂研究、改进传统的小样本大小来加强研究设计。随机试验能够有效地比较不同治疗方法的效果,因为它们可以随机分配参与者到不同的治疗组或对照组,从而减少了偏倚的可能性。避免单臂研究也可以提高研究的可信度。改进传统的小样本大小可以增加研究的统计能力和可靠性。
• 督促FDA建立明确指南
作为受监管方的申请者,也具有"直谏"FDA的权力,要求后者在关键性法规上制定有章可循的条例,而不是模棱两可、法外别传。例如FDORA要求的加速批准决定做出的同时,验证性研究必须"正在进行中"的要求,就存在着很大的"误解空间",FDA也在表示正在制定相关指南,避免"伤及无辜"。
申请者可以在加速批准的申请过程中采取"反客为主"的策略与FDA实现互动,参与新标准的制定。
总结
加速批准可能是FDA最饱受争议的监管活动之一,从Aduhelm到Elevidys,反对的声音从未中断。FDA本来坐拥众多可以佐证自己决策英明的加速批准案例,但似乎都无法抵消那些制造出来的争议。任何的锐意创新,都会与争议甚至错误相生相随。在逐渐完善加速批准制度的过程中,FDA也在寻找正本清源的策略,使得这项本意就在造福患者的政策最大化地扬长避短,既为那些深陷困顿的患者带去希望,也要尽力避免"野狐谈禅"的无效药物恣意妄为。
Ref.
Langreth, R. et al. Drug Companies Are Minting Billions on Unproven Treatments With FDA Shortcut. Bloomberg. 15. 05. 2023.
Rutherford, F. et al. FDA Hearing Targets Unproven $900,000 Drug for Deadly Cancer (1). Bloomberg Law. 16. 11. 2023.
Maclean, R. FDA accelerated approval: implications for treatment innovation in oncology. PharmaLive.com. 01. 04. 2024.
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030