https://www.cphi.cn 2018-01-04 10:11 来源:CPhI制药在线 作者:Dopine
2017年相继有2款细胞免疫疗法产品和一款基因疗法产品获批上市,这无疑具有里程碑式的意义,随着FDA在此类创新产品中的政策倾斜,2018年,将会更加值得期待。你听过CAR-T细胞疗法,那你听过"off-the-shelf"T细胞免疫疗法吗?与现有的CAR-T细胞疗法产品,"off-the-shelf"更适合作为药物开发,笔者在这篇文章中介绍了Atara公司一款高端的"off-the-shelf"T细胞免疫疗法产品--Tabelecleucel。
一. Atara公司正式开展Tabelecleucel两项临床III试验
Atara公司在T细胞免疫疗法产品开发方面具有令人瞩目的研发管线,产品Tabelecleucel,即ATA129,是目前进展最快的一款产品,有望成为第一款上市的"off-the-shelf"T细胞免疫疗法产品,开发适应症为移植后EBV感染引起的淋巴增殖性疾病(post-transplant lymphoproliferative disease,PTLD)以及其他EBV感染相关的血液瘤和实体瘤治疗。
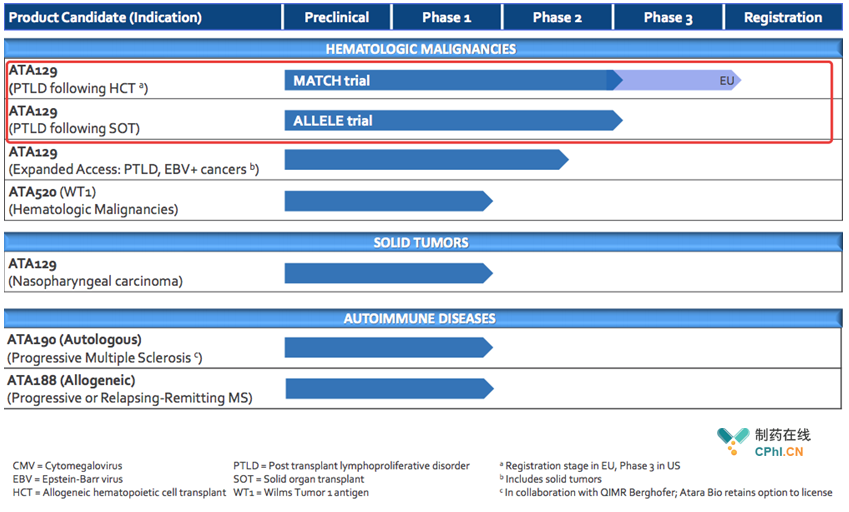
2017年12月29号,FDA批准Tabelecleucel开展2项临床III试验,即:1.利妥昔单抗经治的EBV感染引起的PTLD(MATCH);2.利妥昔单抗或利妥昔单抗联合化疗经治的EBV感染引起的PTLD(ALLELE)。
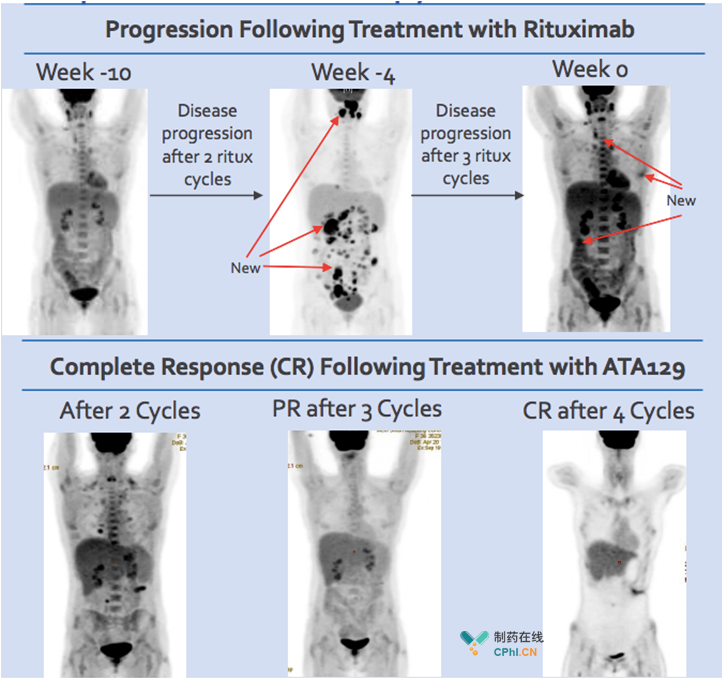
PTLD常与EBV感染紧密相关,造血干细胞移植(HCT)或实体器官移植(SOT)后,利妥昔单抗或联合化疗治疗HCT-EBV-PTLD/ SOT -EBV-PTLD,往往也会出现疾病进展,Tabelecleucel用药则具有明显的疗效,能够使患者达到完全缓解,如下图:
二.Tabelecleucel介绍及已有临床数据展示
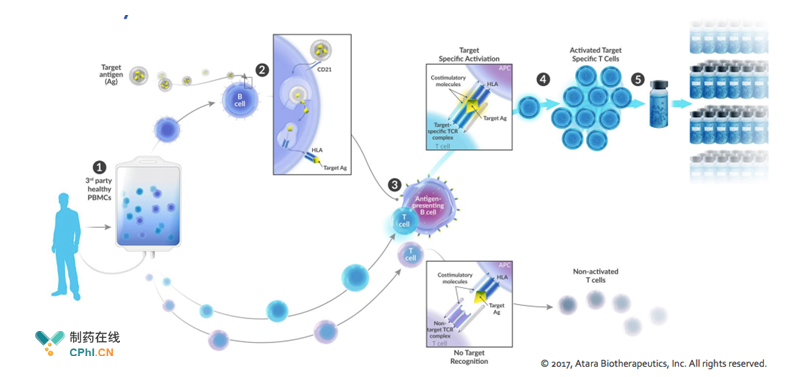
前文提到,Tabelecleucel是一款"off-the-shelf"T细胞免疫疗法产品,该产品利用健康人群的PBMCs,经过公司独创的细胞**T基因改造技术,将其改造成一款具有精确靶标的、适用于各类人群的通用型"off-the-shelf" 细胞**T细胞,与CAR-T细胞相比较,该类产品无需个体化的制备、能够快速扩增、具有更好的安全性和有效性,下图则简要展示了"off-the-shelf" T细胞的制备过程。毫无疑问,"off-the-shelf" T细胞更具有商业化的潜质。
Tabelecleucel目前已完成临床II期试验,并在2017年12月11号,在ASH年会公布了产品在EBV+PTLD患者中的expanded access protocol (EAP)中期数据。
1. 临床II期试验:显著改善患者总体生存期
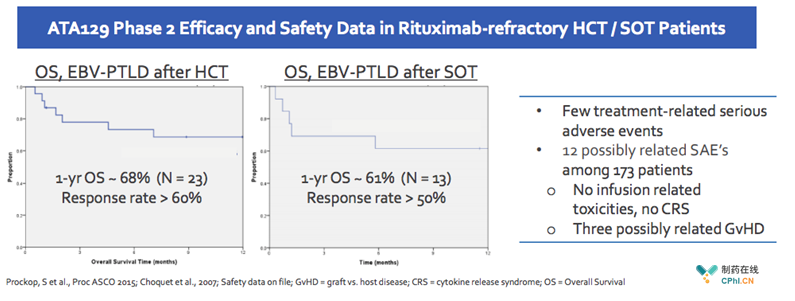
HCT-EBV-PTLD患者,利妥昔单抗治疗失败后,其生存期一般为16-56天,Tabelecleucel治疗后,HCT-EBV-PTLD/ SOT -EBV-PTLD患者1年总体生存期为61%-68%,显著改善了患者的疾病状况。同时,产品没有出现药物相关的严重不良反应,无CRS。
2.2017ASH年会:expanded access protocol (EAP)中期数据公布
2017年12月11号,2017ASH年会公司公布了多中心的Tabelecleucel
临床数据,数据来自5名HCT-EBV-PTLD患者和6名 SOT -EBV-PTLD患者,HCT-EBV-PTLD患者中,ORR为80%;SOT -EBV-PTLD患者中,ORR为83%。1年总体生存期为90.0%。同时并无严重的药物相关不良反应,安全性和有效性数据与临床II期试验数据一致。
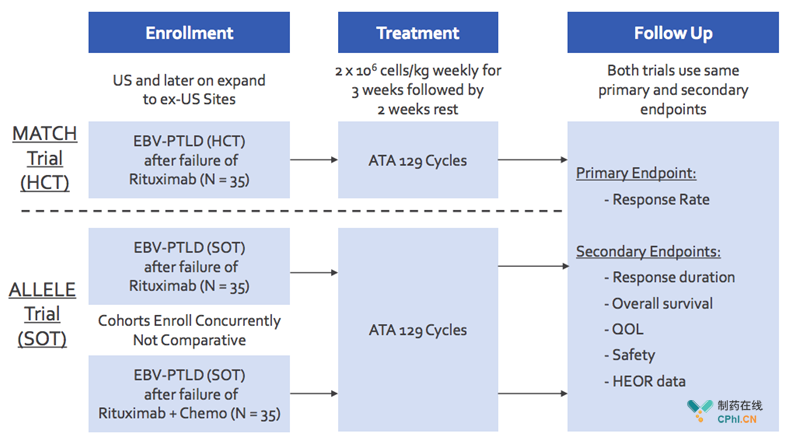
三.Tabelecleucel临床III期试验设计
Tabelecleucel临床III期试验计划招募患者105名,包括35名利妥昔单抗治疗失败HCT-EBV-PTLD患者,35名利妥昔单抗单药治疗失败SOT -EBV-PTLD患者及35名利妥昔单抗联合化疗失败SOT -EBV-PTLD患者。干预方式为2×106 cells/kg·周,2周,主要终点为相应率,次要终点为响应时间、总体生存期等。
目前,药物已获得FDA突破性疗法认定和孤儿药资格,药物将在多个国家提交临床试验申请,同时药物也将探索与默沙东keytruda联合治疗铂类药物耐药或是EBV感染相关的鼻咽癌,药物开发值得关注。
参考资料:
1. http://investors.atarabio.com/news-releases/news-release-details/atara-biotherapeutics-announces-fda-clearance-initiate-two-phase
2. http://investors.atarabio.com/static-files/af55731c-f076-4f6d-b732-1512f70fa001
3. http://investors.atarabio.com/news-releases/news-release-details/atara-biotherapeutics-announces-updated-positive-interim-results
作者简介:Dopine,注册执业药师,河南省药学会会员,就职于河南省某三级甲等医院PIVAS,精于临床药学服务,专注临床用药安全和不合理用药。对国内外医药审评审批政策,研发动态,新药注册审批等长期关注。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030