https://www.cphi.cn 2019-12-26 11:30 来源:CPhI制药在线 作者:知行

2019年12月13日,Horizon Therapeutics宣布FDA皮肤科和眼科药物咨询委员会12票全票通过,支持Teprotumumab获批用于甲状腺眼病的治疗。目前,Teprotumumab正处于FDA的上市审查中,FDA将在2020年3月8日作出决定,如果获批,这将成为首款治疗活动性甲状腺眼病的药物。
甲状腺眼病(Thyroid Eye Disease,TED),又称Graves'眼病(GO),是一种严重的、进行性的、威胁视力的自身免疫性疾病,该疾病经历最多三年的活跃期后会进入稳定期,长发病于患有甲状腺功能亢进症或Graves'患者群中。
活跃期TED主要表现为眼球后部炎症和组织增生,随着疾病进展会导致眼球突出、斜视、复视、甚至失明等严重后果。仅活跃期TED可使用皮质激素类药物部分缓解病情,FDA还未批准针对性疗法。TED转入稳定期后,炎症会消退,而增生组织不会,患者往往只能接受眼部手术。
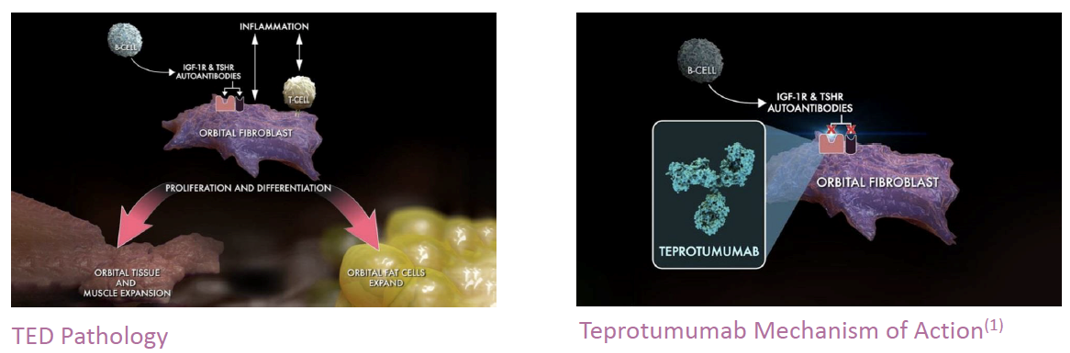
Teprotumumab是Horizon Therapeutics研发的IGF-1R全人源单克隆抗体,可阻断IGF-1R,致使患者眼部细胞内的IGF-1和促甲状腺激素(TSH)活跃水平降低。IGF-1R和促甲状腺激素受体(TSHR)在TED患者眼眶成纤维细胞中水平偏高,两者之间存在着复杂的信号通路网络联系,与疾病发生密切相关。
FDA已授予Teprotumumab治疗活动性TED的突破性药物资格、孤儿药资格、快速通道资格、优先审查资格。
2019年12月13日,FDA皮肤科和眼科药物咨询委员会举行会议,评估Teprotumumab治疗活动性TED的收益风险比,与会人员12票全票通过,支持FDA批准Teprotumumab。
基于一项II期研究和临床III期研究OPTIC的顶线数据,FDA正在审查Teprotumumab的上市申请,并将在2020年3月8日作出决定。如果获批,Teprotumumab将成为首款治疗活动性TED的药物。
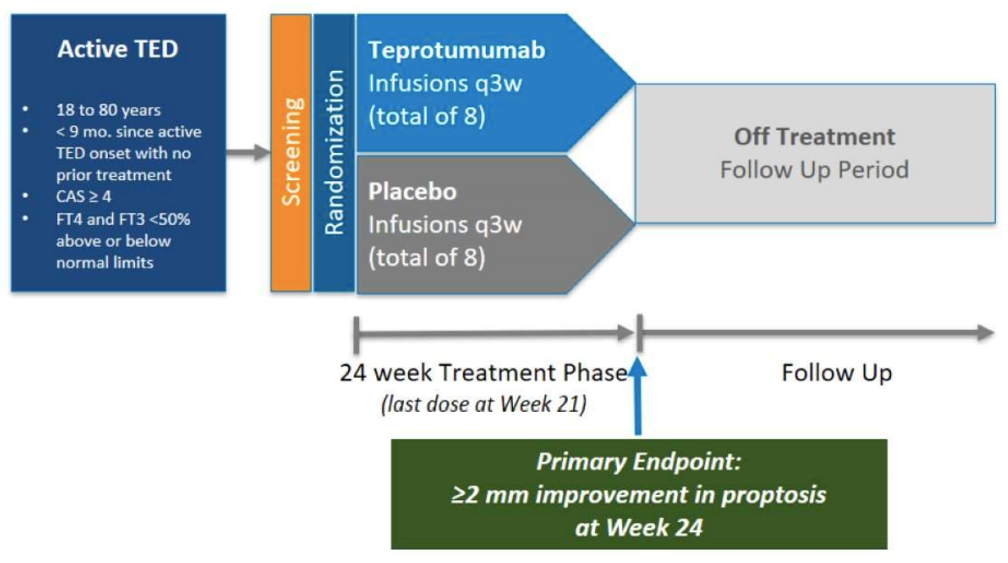
OPTIC(NCT03298867)是一项评估Teprotumumab治疗活跃TED患者的有效性、耐受性和安全性的III期研究,共入组了83名患者,随机分别静脉输注Teprotumumab(41名患者)或安慰剂(42名患者),每3周输注一次,第一次剂量为10 mg/kg,之后的7次每次20 mg/kg。
OPTIC试验达到主要终点,Teprotumumab显著改善了患者眼球突出或鼓胀表现,并且在所有的次要终点上也展现出明显改善,安全性数据与之前的II期临床试验类似,没有发现新的不良反应,具体数据结果如下。
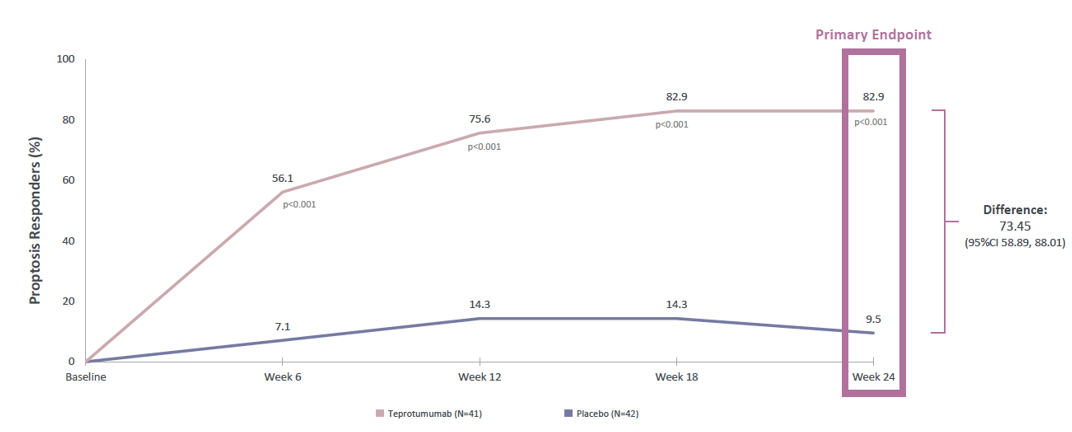
1)主要终点:治疗第24周时,Teprotumumab组有82.9%的患者达到眼球突出或鼓胀相对基线减少≥2 mm,而安慰剂组为9.5%,数据具有统计学显著差异,p<0.001。
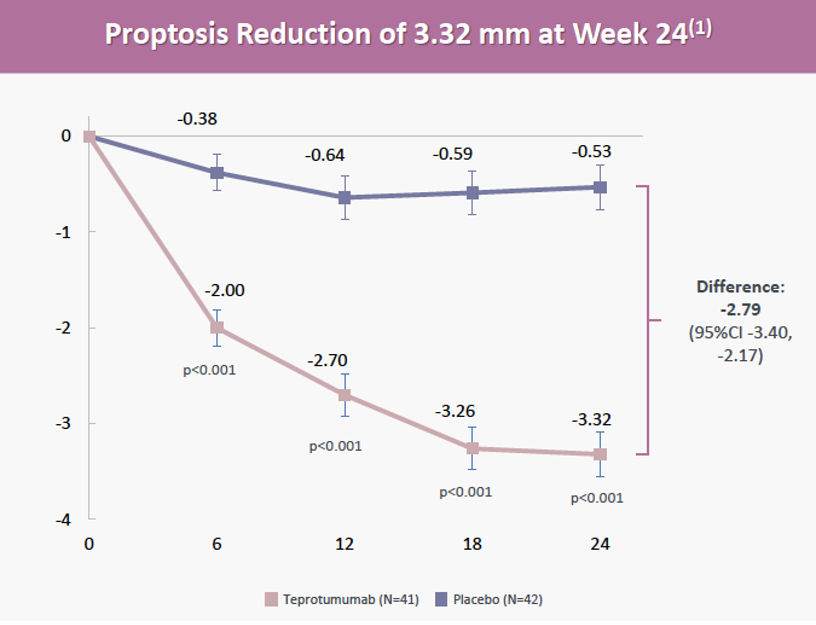
2)次要终点I:眼球突出。治疗第24周时,Teprotumumab组眼球突出相对基线平均减少3.32 mm,安慰剂组为0.53 mm,p<0.001。在所有研究时间点,Teprotumumab与安慰剂在眼球突出相对基线减少方面均具有统计学意义。
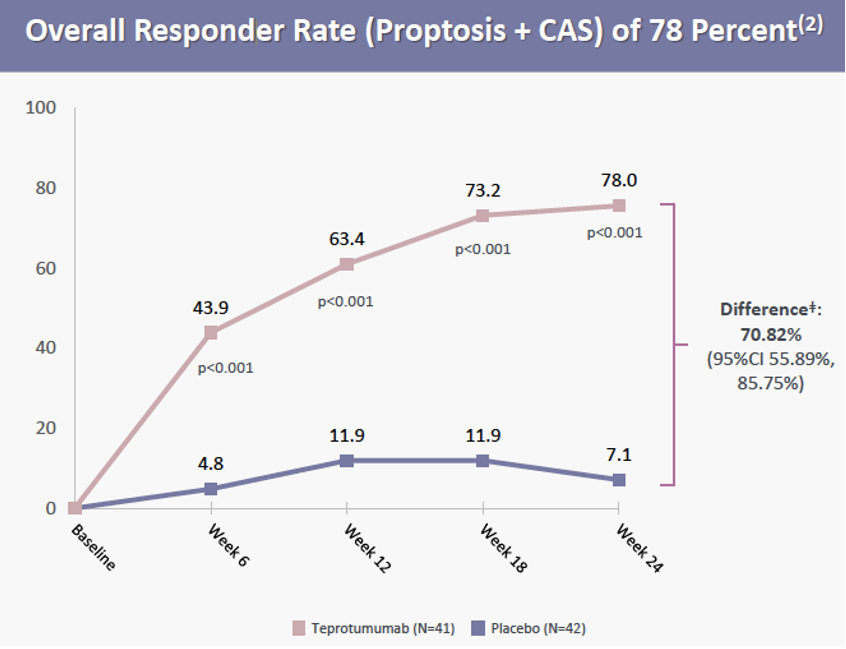
3)次要终点II:总缓解率。治疗第24周时,Teprotumumab组总缓解率(眼球突出减少≥2 mm以及CAS改善≥2分)显著高于安慰剂组(78% vs 7.1%,p<0.001)。
4)次要终点III:复视。治疗第24周时,Teprotumumab组有68%的患者复视程度较基线水平至少改善一级,安慰剂组比例为29%,p=0.001。
5)次要终点IV:生活质量。治疗第24周时,Teprotumumab组Graves'眼病生活质量量表(GO-QoL)平均变化为13.79,这一数值在安慰剂组患者为4.43,p<0.001。这些评分表明,与安慰剂相比,Teprotumumab对患者生活质量有统计学和临床意义的改善(评分改变6分即认为临床意义上显著改善)。
6)次要终点V:CAS评分(Graves'眼病活动评分方法)。治疗第24周时,Teprotumumab组59%的患者CAS评分达到0或1,而安慰剂组的比例为21%,p<0.001。CAS评分从0到7,其中评分0代表Graves'眼病无肿胀或活性。
7)安全性数据与之前的II期临床相似,未出现新的不良事件,多数与治疗相关的不良事件(TEAEs)都属于轻至中度事件(肌肉痉挛、听力损伤、腹泻和肠易激综合征等),Teprotumumab组发现两例严重不良事件,对照组发现一例严重不良事件(SAEs)。

Teprotumumab的III期临床试验OPTIC结果令人瞩目,安全性数据一如之前。与此前的II期试验结果一道,展示了Teprotumumab治疗活跃期TED的显著临床收益。
Teprotumumab临床试验(II期和III期)入组170名患者,而接受Teprotumumab治疗的患者仅为90名,相较于惯常的300名参与者的安全性数据,患者数较少,安全性数据单薄。然而,FDA委员会还是一致同意Teprotumumab上市,可见其临床收益及未满足的患者需求,上市后也可继续对其进行安全性监督研究。目前,Horizon也正在开展OPTIC-X扩展研究,以进一步了解Teprotumumab的长期疗效和安全性。
当前的TED患者只能等活跃期结束后进入稳定期,再通过手术矫正的眼球突出症状,Teprotumumab将为活跃期TED患者提供一种新疗法,患者眼球突出症在活跃期即能达到前所未有的减少。
2019年12月13日FDA委员会的支持是Teprotumumab的上市保障,若获批,Teprotumumab将会为首款能够减少活跃期TED中的眼睛突出的药物,期待这款疗法!
参考来源:
1. Horizon's eye drug teprotumumab wins FDA panel backing in unanimous vote;
2. FDA Advisory Committee Votes Unanimously to Support the Use of Teprotumumab for the Treatment of Thyroid Eye Disease (TED)
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030