https://www.cphi.cn 2024-03-20 13:03 来源:药智头条
近日,据外媒报道,信达生物已经裁撤了其在美国总部和马里兰州Rockville实验室的研发团队,并在近期关闭该机构。据公开信息显示,该研发中心原负责ADC研发工作,有几十名员工。
同时,外网社交媒体上也传来信达生物高管的回应:信达生物ADC生物学前执行总监 Dowdy Jackson 最近发布了关于被信达生物解雇的消息;药物化学研究科学家 Jacob Smith 也在 LinkedIn 上写道,他因停工而失去了工作。

图片来源:触界生物
对于此事,信达生物于3月13日下午作出回应:这一变化不会影响公司在海外的业务,之前的马里兰实验室将会搬迁到加州。
回顾信达生物近年的美国市场拓展之旅,进展并不算很顺利,因此对于此次信达生物关闭马里兰实验室,搬迁加州的调整,业界猜测原因有二:
马里兰州距离加州4000多公里,后者坐拥旧金山湾区,有更适宜创新药企发展的环境,基因泰克、安进、吉利德均坐落于此。相比之下,马里兰州的药企更加big pharma,比如阿斯利康、GSK均在此处设立生产或研发中心。
信达的目标是未来4-5年后实现近200亿元的年度营收,美国市场一定是其中的关键助力。自2022年信迪利单抗闯关FDA折戟后,信达在美国市场的下一步一直悬而未决,如今美国分公司的调整,或是其重启进攻策略的信号。
信达生物成立于2011年,2018年10月在港交所上市,是集研发、CMC、临床开发及商业化能力于一体的生物制药企业。近年来发展迅速,尤其在2023年进展迅猛,喜讯接连:2月6日,信达生物发布2023年Q4财报,其中总产品收入超人民币16亿元,同比增长超65%,
根据信达生物官网显示,信达生物的产品管线涵盖肿瘤、心血管、代谢、自免、眼科等领域,目前已有10款产品获批上市。
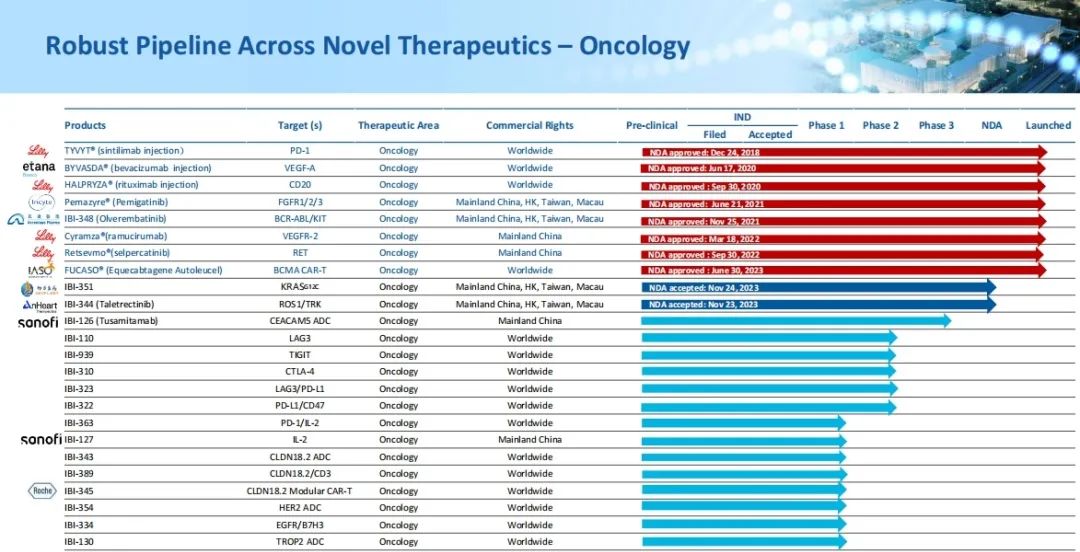
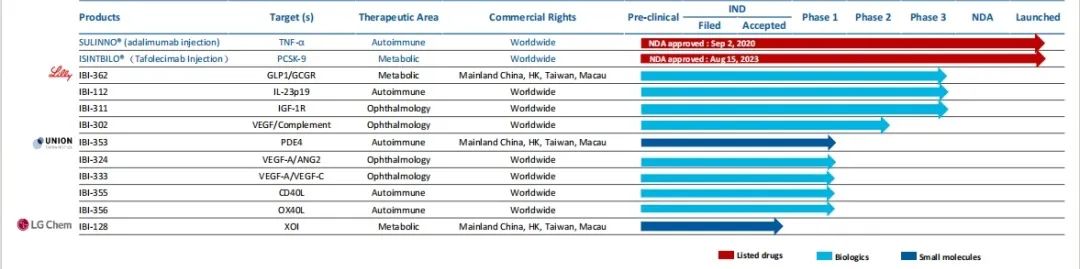
图片来源:信达生物官网
其中,信达生物的重磅PD-1产品达伯舒(信迪利单抗注射液)2023年前三季度销售收入2.8亿美元(约20.13亿元),同比增长19%,占整体产品收入的约47%。
不过信达生物这款PD-1产品也不是一路顺风顺水,2022年曾遭受出海失败,FDA拒绝了信迪利单抗用于治疗新诊断的非鳞状非小细胞肺癌的上市申请,FDA认为信迪利单抗的上市申请仅基于在中国进行的Ⅲ期临床,不足以在美国获得批准,之后礼来将该药退回信达生物。
这点挫折没有击倒信达生物的信心,目前信迪利单抗新适应症的拓展顺利,2023年信迪利单抗新增第七项适应症,用于EGFR-TKI治疗失败非小细胞肺癌。此外,信达生物还在探索信迪利单抗的联合用药,今年2月,信达生物与 ImmVirX宣布达成一项临床研究和供货合作协议,将就信迪利单抗注射液与溶瘤病毒候选药物IVX037的联合治疗开展临床研究合作。ImmVirX目前正在澳大利亚开展IVX037的临床I期研究;临床Ib研究计划于2024年中在澳大利亚启动,评估IVX037联合信迪利单抗(静脉注射)在晚期结直肠、卵巢和胃癌患者中的抗肿瘤活性和耐受性,计划入组约45名患者。根据合作协议,信达生物将为这项多中心临床试验提供信迪利单抗注射液。
除PD-1产品达伯舒以外,信达生物的其余产品也走在正轨之上。2023年,贝伐珠单抗注射液新增第八项适应症纳入2023年版国家医保药品目录,是中国唯一获批用于EGFR-TKI治疗失败非小细胞肺癌的医保PD-1抑制剂和医保贝伐珠单抗;奥雷巴替尼片获批新适应症,用于更广泛的慢性髓细胞白血病(CML)患者;2款创新肿瘤靶向药物IBI-344(ROS1抑制剂)和IBI-351(KRAS G12C抑制剂)的新药上市申请获国家药品监督管理局受理并授予优先审评资格;重组抗胰岛素样生长因子1受体(IGF -1R)抗体注射液(研发代号:IBI311)在中国甲状腺眼病(TED)受试者中开展的III期注册临床研究(RESTORE-1)达成主要终点...
ADC药物IBI126、IBI343、IBI354、IBI130等也在正常发展中,2024年2月IBI343进入注册III期临床,此外,信达生物与礼来制药合作开发的玛仕度肽的上市申请已获受理,该药也为全球首 个申报上市的GLP-1R/GCGR双重激动剂,拟用于成人肥胖或超重患者的长期体重控制。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030