https://www.cphi.cn 2018-01-16 09:15 来源:CPhI制药在线 作者:菜菜
近日,科伦药业启动西妥昔单抗生物类似药KL140的Ⅲ期临床,成为继张江生物和中信国健(由康宁杰瑞转让)后第3个进入Ⅲ期临床的药企。在阿达木、贝伐珠、曲妥珠、利妥昔、西妥昔这五大单抗中,做西妥昔单抗的药企最少,因为耗资大但是市场小,但科伦选择做这个,且似乎要把KL140培养成该公司第一个上市的生物类似药,这到底是缺心眼还是独具慧眼,time wil tell。
西妥昔单抗"白皮书"
西妥昔单抗(Cetuximab,英文商品名为ERBITUX,中文商品名为爱必妥)是Imclone(2008年被礼来收购)与BMS联合开发的人鼠嵌合抗体。该药于2003年12月首次在瑞士上市,为第一个上市的靶向单克隆抗体,于 2004 年获得 FDA 批准;西妥昔单抗于 2006 年进入中国(中标价在 3800元/0.2mg 以上)。
目前在全球范围内获批的适应症有:转移性头颈癌,非转移性头颈癌,转移性结直肠癌,非小细胞肺癌等;在国内批准的适应症有:爱必妥单用或与伊立替康(irinotecan)联用于表皮生长因子(EGF)受体过度表达的,对以伊立替康为基础的化疗方案耐药的转移性直肠癌的治疗。该药美国专利到期时间为2015年,欧洲专利到期时间为2014年,中国专利到期时间为 2017 年二季度。2016 年西妥昔单抗的全球销售总额约为16.73 亿美元(-0.067%),市场趋于稳定,中国市场由于适应症局限,规模并不大。
近年西妥昔单抗国内重点城市医院销售额及增长率(数据来源:PDB)
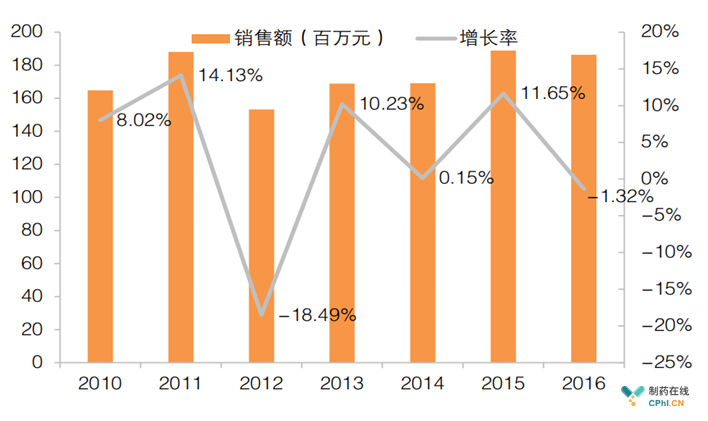
国外药企对于仿制西妥昔单抗并不热情,而国内药企热情有余但实力欠佳,因此目前国内外还没有西妥昔单抗生物类似药上市。
机智or鸡贼:以安慰剂为对照
此次,科伦药业启动的西妥昔单抗生物类似药KL140的Ⅲ期临床中,对照药选用的是安慰剂,笔者在"药物临床试验登记与信息公示平台"上查询到的具体信息如下:


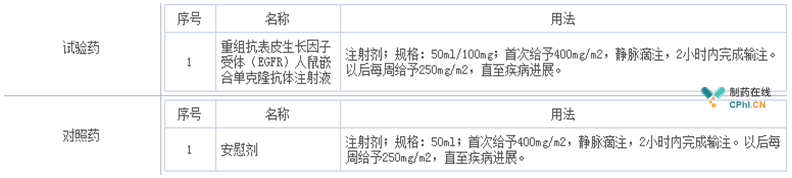
对于为什么科伦药业可以选用安慰剂作为对照的问题,有业内资深人士认为,因为原研药西妥昔单抗的规格是100mg/20ml,而科伦药业KL140的规格是100mg/50ml,与原研药有所不同,因此可以选用安慰剂作为对照。且对于活性成分类似、规格不同的生物制品,注册法规没有明确规定怎么处理,所谓"法无禁止即可为",科伦按对自己最有利的方向去做就可以了,即做的时候按创新药用安慰剂对照,卖的时候按仿制药推广到所有适应症。这样一来科伦药业临床试验成本就降低了很多(一般买原研药作为对照药价格都很贵)。
目前进度最快的三家依次是张江生物、中信国健、科伦药业,其中,复宏汉霖的已经转让给景峰医药。
国内申报西妥昔单抗生物类似药情况(资料来源:药智数据)
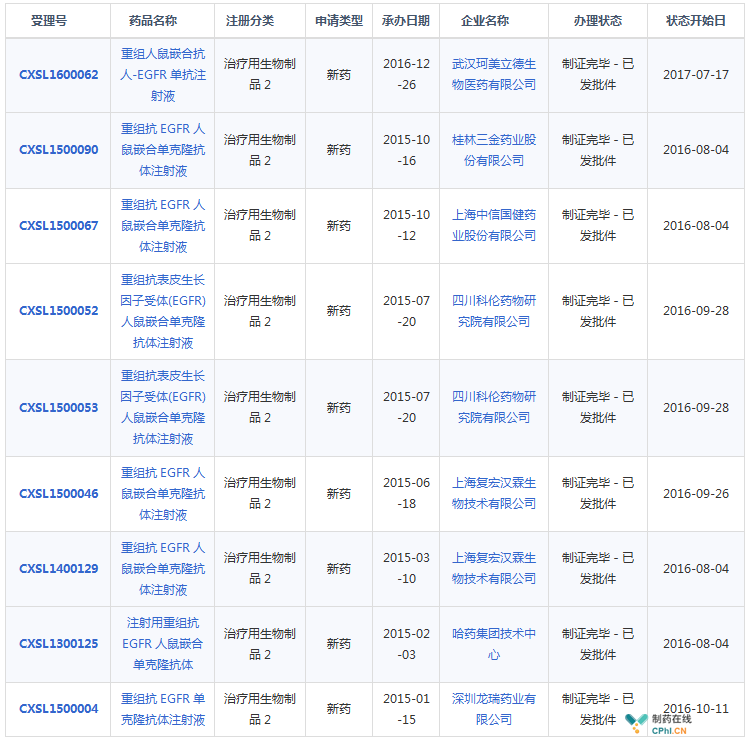
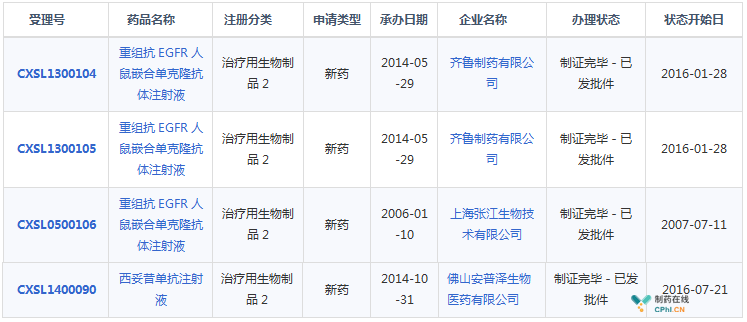
虽然西妥昔单抗生物类似药是业内公认的烧钱大坑,但是生物类似药绝对是一片蓝海。
生物类似药-绝对蓝海
Frost & Sullivan 预计2016-2021年中国生物药将保持16.4%的年复合增长率,到2021 年达到3269 亿元的市场规模。按照全球生物类似药占10%比重测算,中国生物类似药的规模将超300亿元人民币。但到目前为止,FDA批准上市的生物类似药有7个,EMA批准上市的生物类似药有38个,而CFDA至今还未批准1个生物类似药上市。
国内生物类似药利好政策一览
2015年2月28日,CDE发布了《生物类似药研发与评价技术指导原则(试行)》,确定了生物类似药的定义和监管框架。为生物制药在中国的上市提供了另一途径。与美国和欧盟的监管当局相似,我国CDE也希望制药公司提交生物类似药的详细结构和功能特性,以便与参照药进行比较。另外,CDE还采取了与发达国家相似的渐进式方法,通过比较药理学数据、非临床研究和临床研究以评价相似性;
2017年3月1日,国家药典委员会发布关于对"生物制品通用名命名原则规程"征求意见的通知,规范生物制品通用名方法,生物类似药命名和原研无区别。我国生物类似药管理逐步走向正轨,未来类似的单抗药物须以生物类似药申报,很难再以新药申报的方式获批,提高了单抗研发的壁垒,本次命名原则规程是对这一政策导向的细则;
2017年10月8日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,此次两办《意见》明确提出"支持生物类似药"。与欧美发达国家对生物类似药的监管步调在战略上保持高度一致,表明国家对于高质量生物类似药的重视与支持;
2017年12月26日,国家发改委发布《增强制造业核心竞争力三年行动计划(2018-2020年)》的通知。政策再度支持创新药,同时明确首家生物类似药为高端药品。
作者简介:菜菜,上海交通大学药学硕士,曾工作于科学技术情报研究所,现为药监系统从业人员,擅长解读行业法规、最新药研动态等。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030