https://www.cphi.cn 2023-07-13 09:57 来源:药渡 作者:哥哈骎
2023年上半年,FDA共批准了36项BLA(Biologic License Application,生物药上市许可申请)和NDA(new drug application,新药申请),其中BLA 10项,NDA 26项。下半年CDER(药物评价与研究中心)与CBER(生物制剂评价与研究中心)还将面临多项申请的PDUFA(处方药使用者费用法案)日期,其中包含多项令人关注的项目。
01
Zuranolone
• 研发机构:Biogen和Sage
• 适应症:重度抑郁症和产后抑郁症
• PDUFA日期:2023年8月5日
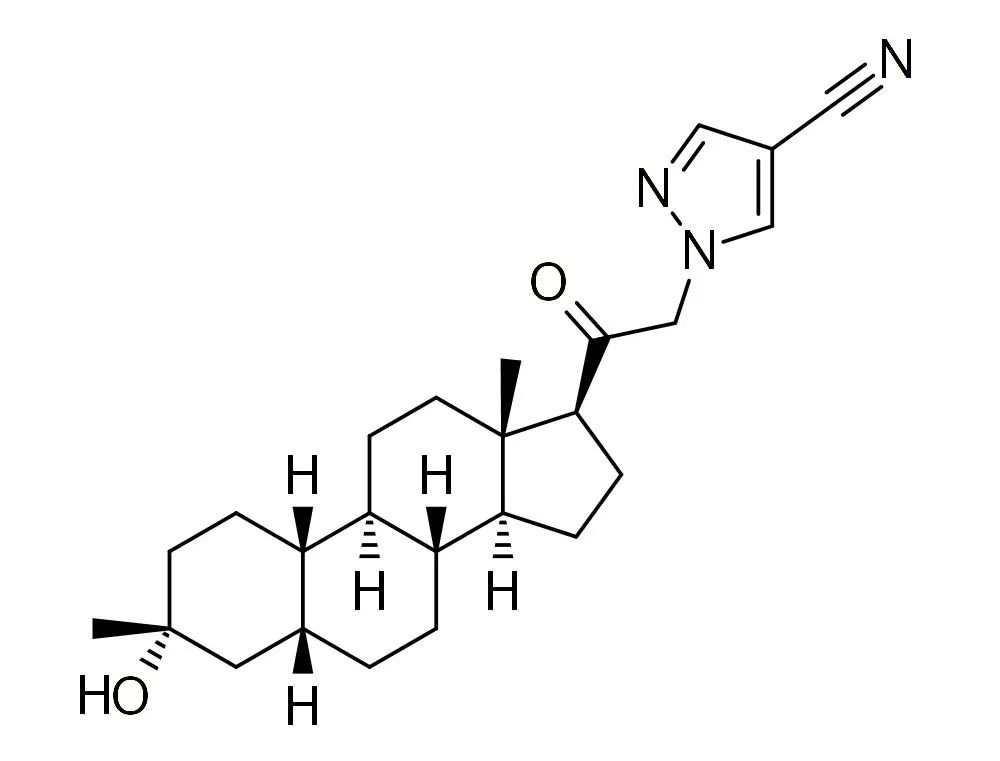
图1. Zuranolone结构式,来源:药渡数据
Biogen和Sage Therapeutics联合开发的Zuranolone有可能成为重度抑郁症(MDD)和产后抑郁症(PPD)的首 个速效疗法。
Zuranolone是一种神经活性类固醇,可作为GABA-A受体的正变构调节剂,在临床研究中显示出对抑郁症状的快速和持续改善。在PPD的III期试验中,zuranolone实现了主要终点和关键的次要终点,与安慰剂相比,抑郁症状在统计学上显著减少。Zuranolone在其III期MDD试验中,同样达到了其主要终点和关键的次要终点,用药三天后抑郁症状实现了统计学意义的显著降低。
Zuranolone的最大看点来自于它的快速起效,这对于重度抑郁症和产后抑郁症这样的适应症尤为重要。如果获得批准,这将是市场上第一个为期14天疗程的抑郁症治疗药物。目前对这些疾病的治疗方案都是长期的,6-8周内产生疗效。
FDA于2月接受了Zuranolone的新药申请(NDA),并授予其优先审查权。
02
Tecentriq(阿替利珠单抗)
• 研发机构:罗氏
• 适应症:非小细胞肺癌(NSCLC)
• PDFUA 日期:2023年9月15日
图2. Tecentriq示意图,来源:药渡数据
罗氏正在努力寻求将其重磅药物——抗PD-(L)1疗法Tecentriq(阿替利珠单抗,atezolizumab)的皮下注射制剂针对非小细胞肺癌(NSCLC)患者的批准。
2022年8月报告的III期IMscin001研究数据显示,在晚期NSCLC患者中,Tecentriq皮下注射制剂药效不劣于静脉注射。Tecentriq的皮下注射配方将治疗时间缩短到几分钟,而静脉输注则要长达一个小时。
Tecentriq的皮下注射制剂的批准,可能意味着直至2032年Tecentriq将拥有更多的市场独占权。
03
Patisiran和Eplontersen
• 研发机构:Alnylam和Ionis/AstraZeneca
• 适应症:AATR (transthyretin amyloidosis,转甲状腺素蛋白淀粉样变性)心肌病和ATTR多发性神经病
• PDUFA日期:2023年10月8日和2023年12月22日
ATTR适应症领域可能会在今年第四季度获得两项新的FDA批准,互为竞争对手的Alnylam和Ionis/AstraZeneca都在积极地寻求新的适应症。
10月,FDA将决定patisiran的补充批准,用于与ATTR相关的心肌病。12月,Ionis和AZ的eplontersen将接受审查,用于ATTR多发性神经病(ATTRv-PN)。
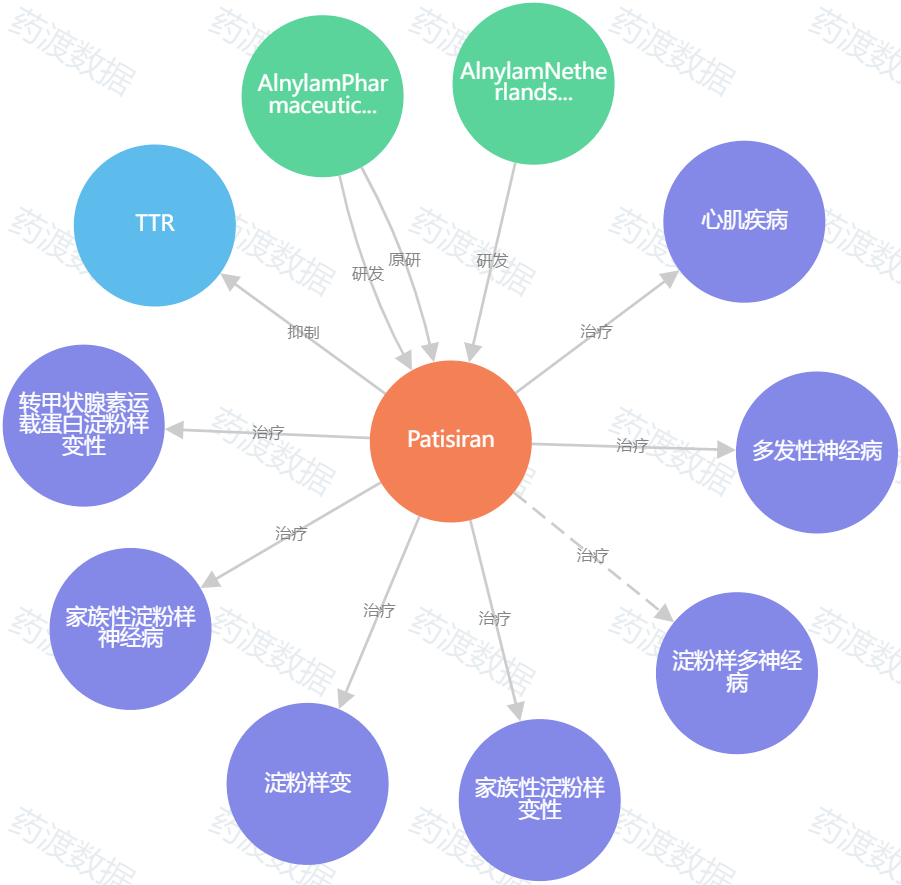
图3. Patisiran知识图谱,来源:药渡数据
Patisiran是一种RNAi疗法,已经被批准用于治疗ATTRv-PN,商品名为Onpattro,于2018年获得批准。在伴有心肌病的ATTR中,patisiran在随访12个月后与安慰剂相比,对功能和生活质量均显示出有利影响。
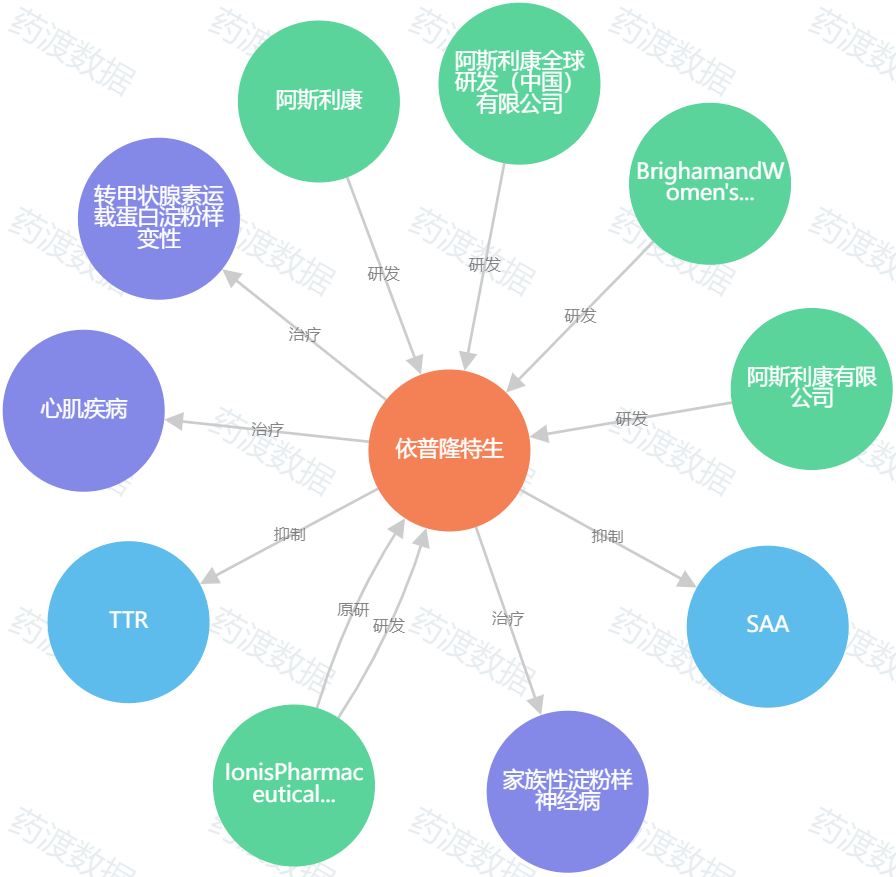
图4. eplontersen知识图谱,来源:药渡数据
与此同时,Ionis和AZ也希望通过他们的反义药物eplontersen打入ATTR市场。在一项III期试验中,47%的服用该eplontersen的患者表现出神经病变的改善。
04
Lifileucel
• 研发机构:Iovance
• 适应症:晚期黑色素瘤
• PDUFA日期:2023年11月25日
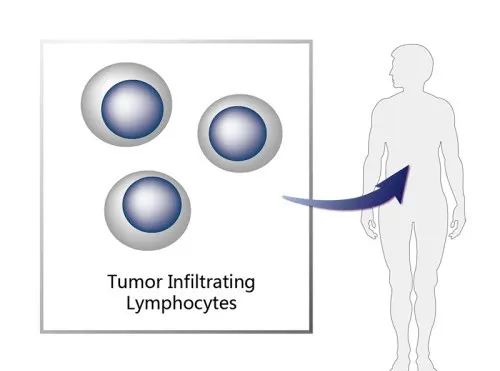
图5. lifileucel作用机制示意图,来源:药渡数据
肿瘤浸润淋巴细胞(TIL)的过继细胞疗法在黑色素瘤的治疗中势头强劲,但迄今为止,还没有公司在这个领域成功撞线。这种空白状态可能会在今年11月发生突破,届时,FDA将对Iovance Biotherapeutics的晚期黑色素瘤药物——lifileucel做出决定。
Iovance于3月向FDA提交了BLA文件。除了可能是首 个晚期黑色素瘤患者的个体化一次性细胞疗法外,lifileucel还将是不可切除或转移性黑色素瘤在先前抗PD-1/L1治疗和靶向治疗之后进展的患者的治疗首选。
Lifileucel在三年多的随访中获得了31%的客观缓解率,其中42%的反应持续两年或更长时间。
05
NurOwn
• 研发机构:BrainStorm
• 适应症:肌萎缩侧索硬化症
• PDUFA日期:2023年12月8日
BrainStorm Cell Therapeutics的NurOwn,它对抗肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)的漫漫长路有望在12月初抵达终点。
这家总部位于以色列和纽约的生物制药公司原本要在2021年就递交BLA申请,但 FDA表示,他们的III期试验没有收获支持BLA所需的实质性证据。目前,该试验达到了主要的治疗反应终点,34.7%的患者在ALS功能评定量表中(ALSFRS-R)每月改善1.5分,治疗改善效果良好。
如果获得批准,NurOwn将成为继Biogen和Ionis 4月份获批的Qalsody(针对SOD1-ALS)之后,2023年的第二种新的ALS疗法。
06
Exa-cel和Lovo-cel
• 研发机构:CRISPR Therapeutics/Vertex和Bluebird bio
• 适应症:镰状细胞病(SCD)
• PDUFA日期:2023年12月8日和2023年12月20日
镰状细胞病(SCD)患者有望在今年拥有两项新的治疗选择。
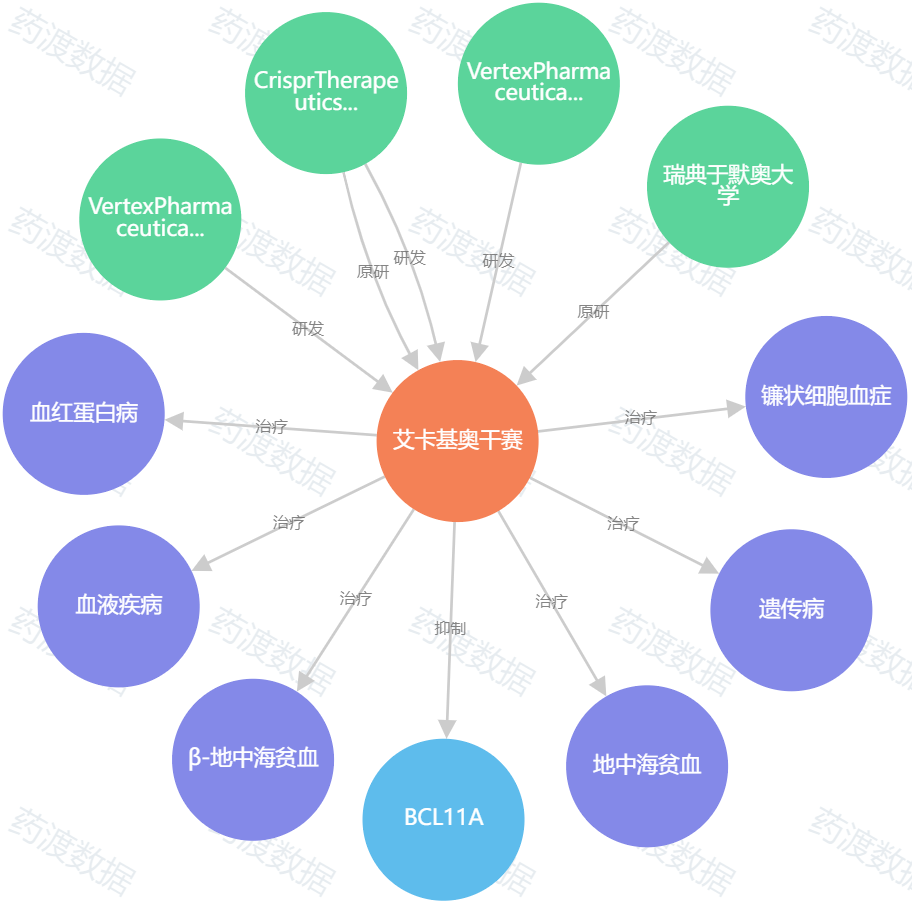
图6. exa-cel知识图谱,来源:药渡数据
FDA将在12月8日(与BrainStorm的肌萎缩侧索硬化症疗法NurOwn同一天)对Vertex和CRISPR Therapeutics的exa-cel(exagamglogene autotemcel)进行审批。如果获得批准,exa-cel将成为FDA批准的用于任何适应症的第一个CRISPR基因编辑产品。SCD和输血依赖性β地中海贫血(TDT)适应症的exa-cel的BLA,是第一个被FDA接受的CRISPR疗法申请。TDT的PDUFA日期为2024年3月30日。
SCD和TDT都是由β-珠蛋白基因突变引起的,β-珠蛋白基因产生对血红蛋白功能至关重要的蛋白质。这些突变引起血红蛋白异常,从而导致两种疾病的贫血特征。Exa-cel是一种自体离体基因编辑疗法,它使用CRISPR-Cas9系统编辑患者的造血干细胞,以产生高水平的胎儿血红蛋白(fetal hemoglobin)。exa-cel可以预防或大幅减少TDT输血和SCD血管闭塞危象(vaso-occlusive crises)超过30个月。
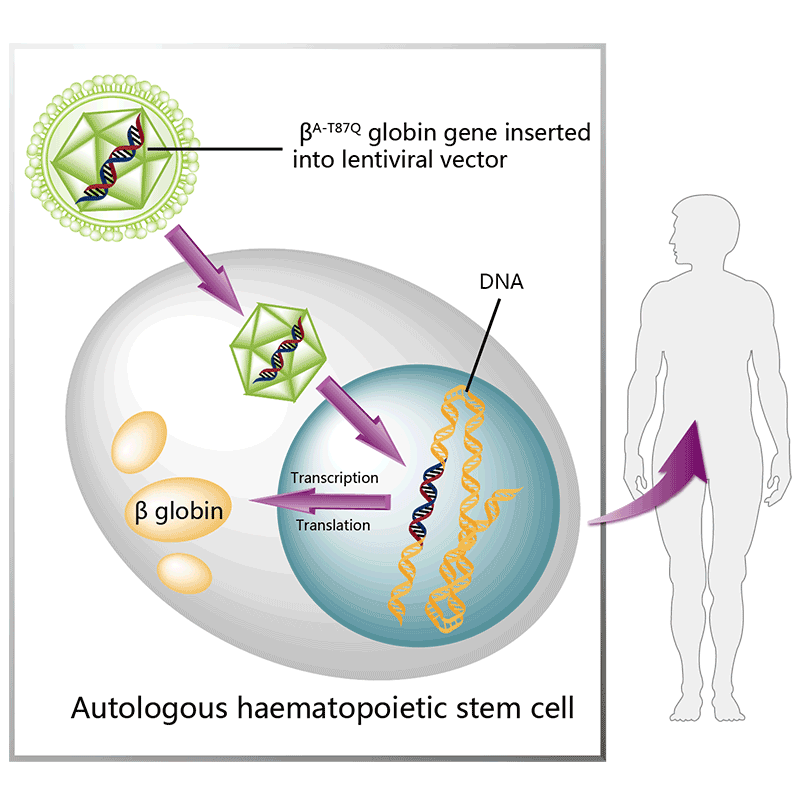
图7. lovo-cel作用机制示意图,来源:药渡数据
紧随Vertex的CRISPR之后的是Bluebird bio,后者正在为他们的第三款罕见疾病的基因疗法做准备。与exa-cel一样,lovo-cel(lovotibeglogene autotemcel)是一种一次性基因疗法,它旨在将β-珠蛋白基因修饰形式的拷贝添加到患者提取的造血干细胞中。FDA将于12月20日对lovo-cel的批准做出决定。
07
Capivasertib
• 研发机构:AstraZeneca
• 适应症:乳腺癌
• PDUFA时间:2023年12月31日
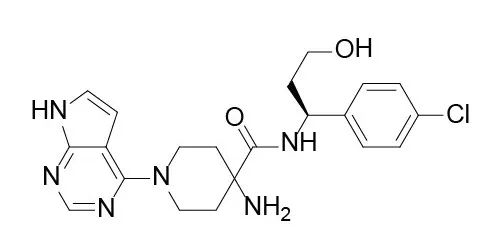
图8. Capivasertib结构式,来源:药渡数据
Capivasertib是一种新型、高效、选择性ATP竞争性泛AKT激酶抑制剂,对三种亚型AKT1、AKT2和AKT3具有相似的活性。它的3期试验可为监管部门批准capivasertib联合fulvestrant,作为转移性HR阳性/HER2阴性乳腺癌的二线或后期治疗,以及与紫杉醇联合为局部晚期或转移性三阴性乳腺癌的一线治疗提供依据。据预测,capivasertib具有成为重磅炸 弹的潜质。
08
Mirikizumab
• 研发机构:礼来
• 适应症:溃疡性结肠炎和克罗恩病
Mirikizumab是一种单克隆抗体,可能成为溃疡性结肠炎ulcerative colitis (UC)的首 创治疗药物,以及用于克罗恩病的第三类治疗方法。作为具有新作用机制的一系列新兴疗法的一部分,它将有助于提升这些疗法不断增长的市场份额。尽管礼来的Mirikizumab的BLA申请在今年4月份因为制造问题收到了FDA的完整回复函(CRL),但其临床数目并没有问题,估计礼来在进行调整之后,mirikizumab将于年内获批,应用于溃疡性结肠炎,并有望于2025年获批用于治疗克罗恩病。
参考资料:
1. McKenzie, H. 9 Highly Anticipated FDA Decisions in the Second Half of 2023. Biospace. 29. 06. 2023.
专栏作者
哥哈骎
南开大学本科、硕士,德国比勒菲尔德大学博士。多肽化学、多肽API GMP生产专家、欧洲制药公司首席科学家;
拥有Lean Six Sigma黑带认证;
著有专著《Side Reactions in Peptide Synthesis》。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030