https://www.cphi.cn 2023-12-08 11:15 来源:药智网 作者:十七
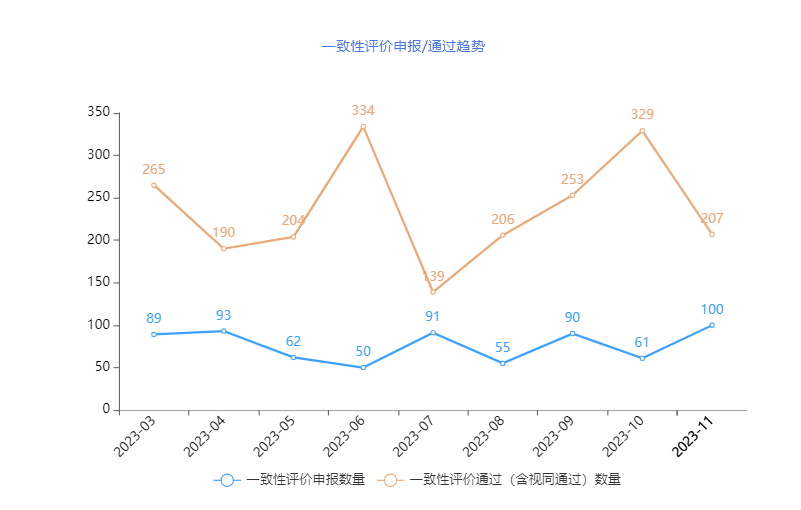
2023年通过/视同通过一致性评价的数量可谓“跌宕起伏”,通过受理号数量多时可达到300+,数量少时,仅一百多,7月过评数量最低,此后连续攀升,11月有207个受理号过评,接近2023年全年的平均过评数量。(文末附2023年11月申报与过评一致性评价详情表)
01
过评详情
2023年11月,有80个一致性评价补充申请受理号通过一致性评价,和127个新注册分类仿制药上市申请受理号视同通过一致性评价,共涉及136家企业的120个品种,其中11个品种为首家过评,6个品种为一致性评价补充申请首家过评。
由于部分新批准药品还没能收集到详细信息等原因,导致一致性评价数据库中的数据和注册数据可能会存在差异,现在将整理出的2023年11月首家过评的14个药品信息放在表1中,供参考。
从过评企业而言,11月共有207个受理号过评,涉及136家企业的120个品种,其中浙江华海药业有8个受理号过评,位居第一,其次为石家庄四药和齐鲁制药,各有4个受理号过评,并列第二。企业通过受理号数详情见下图。
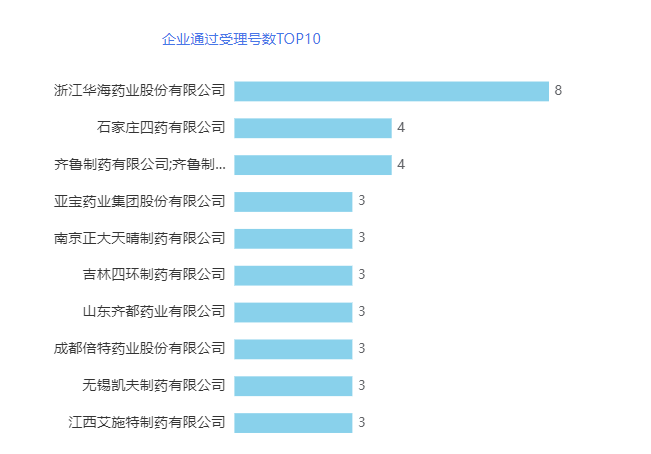
华海药业创立于1989年,总部位于中国浙江,公司产品涵盖:心血管类、精神障碍类、神经系统类、抗感染类等领域。目前,华海药业共有56个品种共93个受理号通过/视同通过一致性评价,其中以一致性评价补充申请过评一致性的共有10个品种,8个为首家过评,还有7个首家按新注册分类化学仿制药申报上市的品种。11月共有2个品种共8个受理号视同通过一致性评价,分别为盐酸托莫西汀胶囊和他达拉非片。
石家庄四药有限公司是以创新药、仿制药、特色原料药、高端制剂及药包材等产业链多领域研发与产业化协同发展的大型高新技术制药企业,2007年,企业在香港主板上市。目前,石家庄四药有66个品种共84个受理号通过/视同通过一致性评价,其中以一致性评价补充申请过评一致性的共有22个品种,3个为首家过评,还有7个首家按新注册分类化学仿制药申报上市的品种。11月共3个品种通过/视同通过一致性评价,分别为盐酸替罗非班氯化钠注射液、磷酸特地唑胺片和氯化钾注射液。
齐鲁制药集团始于1981,总部位于山东省济南市,主要从事治疗肿瘤、心脑血管、抗感染、精神系统、神经系统、眼科疾病的制剂及其原料药的研制、生产与销售。目前,齐鲁制药有106个品种共180个受理号通过/视同通过一致性评价,其中以一致性评价补充申请过评一致性的共有38个品种,17个为首家过评,还有22个首家按新注册分类化学仿制药申报上市的品种。11月共3个品种通过/视同通过一致性评价,分别为注射用艾司奥美拉唑钠、盐酸奥洛他定滴眼液和玻璃酸钠滴眼液。
从品种看,11月有120个品种过评,其中注射用头孢哌酮钠舒巴坦钠和盐酸托莫西汀胶囊有7个受理号过评占据品种通过企业数榜首,然后是注射用哌拉西林钠有6个受理号过评并列第二。详情见下图。
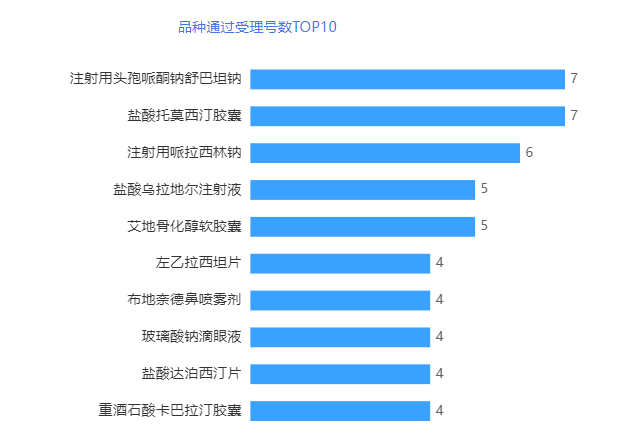
注射用头孢哌酮钠舒巴坦钠为医保乙类处方药,用于治疗由敏感细菌所引起的下列感染:呼吸道感染(上呼吸道与下呼吸道);泌尿道感染(上泌尿道与下泌尿道);腹膜炎、胆囊炎、胆管炎和其它腹内感染;败血症、脑膜炎;皮肤及软组织感染、眼部感染、骨骼及关节感染;盆腔炎、子宫内膜炎、淋病和其它生殖器、道感染等;预防因腹腔、妇科、心血管、骨科及整形手术所引起的手术后感染。目前,注射用头孢哌酮钠舒巴坦钠共有15家企业以一致性评价补充申请通过一致性评价,暂无视同通过厂家。11月共3家企业过评,分别为海南通用三洋药业有限公司、海南海灵化学制药有限公司和苏州东瑞制药有限公司。
盐酸托莫西汀胶囊为医保乙类处方药,用于治疗儿童和青少年(6岁-18岁)的注意缺陷/多动障碍(ADHD)。目前,盐酸托莫西汀胶囊共有2家企业以一致性评价补充申请通过一致性评价,4家企业以新注册分类仿制药上市,视同通过一致性评价。11月有浙江华海药业股份有限公司1个视同通过一致性评价。
注射用哌拉西林钠为医保甲类处方药,适用于1.敏感肠杆菌科细菌、铜绿假单胞菌、不动杆菌属所致的败血症、上尿路及复杂性尿路感染、呼吸道感染、胆道感染、腹腔感染、盆腔感染以及皮肤、软组织感染等。2.呱拉西林与氨基糖首类联合应用亦可用于有粒细胞减少症免疫缺陷病人的感染。目前,注射用哌拉西林钠共有8家企业以一致性评价补充申请通过一致性评价,首家过评企业为瑞阳制药股份有限公司,3家企业以新注册分类仿制药上市,视同通过一致性评价。11月有成都倍特药业股份有限公司、福安药业集团庆余堂制药有限公司2个企业通过/视同通过一致性评价。
02
49个品种申报,注射剂超70%
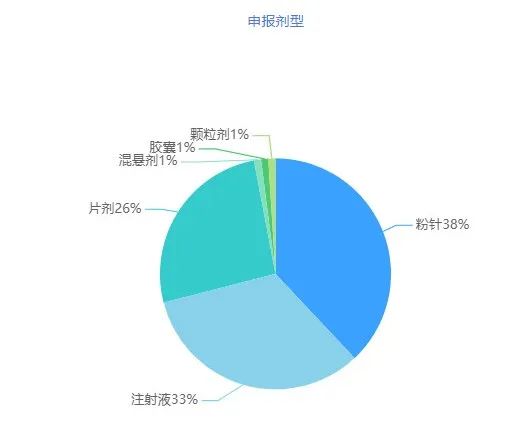
2023年11月,CDE新增一致性评价受理号100个,涉及61家企业的49个品种,其中注射剂申报占比超过70%。
申报品种而言,2023年11月,碳酸氢钠注射液有6个企业提交一致性评价补充申请,继10月后再一次位列第一,其次为注射用兰索拉唑有3家企业申报,据第二。详情见下图。
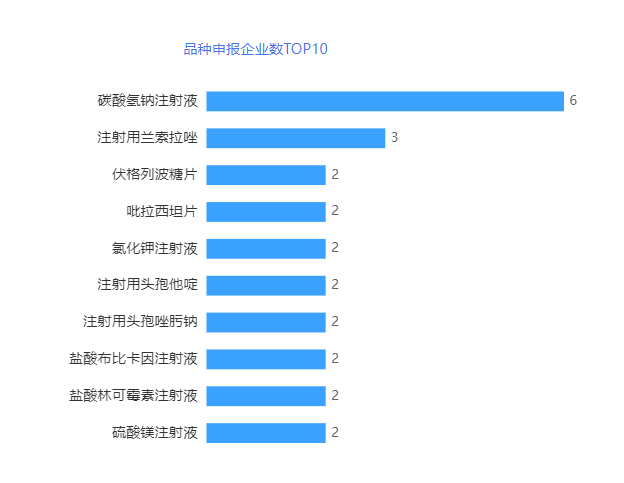
碳酸氢钠注射液是医保甲类处方药,适应症为1.治疗代谢性酸中毒。治疗轻至中度代谢性酸中毒,以口服为宜。重度代谢性酸中毒则应静脉滴注,如严重肾脏病、循环衰竭、心肺复苏、体外循环及严重的原发性乳酸性酸中毒、糖尿病酮症酸中毒等。2.碱化尿液。用于尿酸性肾结石的预防,减少磺胺类药物的肾毒性,及急性溶血防止血红蛋白沉积在肾小管。3.作为制酸药,治疗胃酸过多引起的症状。4.静脉滴注对某些药物中毒有非特异性的治疗作用,如巴比 妥类、水杨酸类药物及甲醇等中毒。但本品禁用于吞食强酸中毒时的洗胃,因本品与强酸反应产生大量二氧化碳,导致急性胃扩张甚至胃破裂。
目前,碳酸氢钠注射液共有2家企业以一致性评价补充申请通过一致性评价,还有13家企业已提交一致性评价补充申请或仿制药上市申请,11月共6家企业提交一致性评价补充申请,分别为四川太平洋药业有限责任公司、河北天成药业股份有限公司、华润双鹤利民药业(济南)有限公司、哈尔滨三联药业股份有限公司、四川科伦药业股份有限公司分别与昆明南疆制药有限公司和黑龙江博宇制药有限公司联合申报的一个受理号。
注射用兰索拉唑为医保乙类处方药,适应症为用于口服疗法不适用的伴有出血的十二指肠溃疡。目前,注射用兰索拉唑已有16家企业以一致性评价补充申请通过一致性评价,6家企业以仿制药新注册分类视同通过一致性评价,还有3家企业首次提交一致性评价补充申请,还在审评中。
从企业角度,2023年11月,华润双鹤利民药业(济南)、宜昌人福和苏州二叶均有2个品种申报一致评价补充申请。详情见下图。
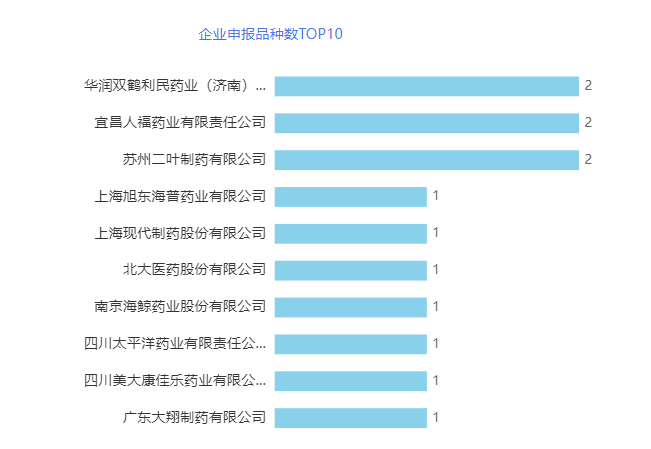
华润双鹤利民药业(济南)有限公司经营范围包括化学药品制剂制造;西药的制造、销售【小容量注射剂(含激素类)、片剂、硬胶囊剂、原料药(兰素拉唑)】;货物进出口、技术进出口。目前,华润双鹤利民药业(济南)有限公司以一致性评价补充申请过评一致性的共有11个品种,1个为首家过评,还有5个按新注册分类化学仿制药申报上市的品种。11月共有2个品种2个一致性评价补充申请受理号被受理,分别为氯化钾注射液和碳酸氢钠注射液。
宜昌人福药业有限责任公司以麻 醉科用药为核心,以抗癌药、心脑血管药、抗感冒药、肝胆疾病用药为支柱产品。目前,宜昌人福药业有限责任公司以一致性评价补充申请过评一致性的共有28个品种,11个为首家过评,还有7个首家按新注册分类化学仿制药申报上市的品种。11月共有2个品种3个一致性评价补充申请受理号被受理,分别为吡拉西坦片和盐酸林可霉素注射液。
苏州二叶制药有限公司前身为苏州第二制药厂,是以生产原料药、粉针剂(含青霉素类、头孢类)、冻干粉针剂和口服制剂的综合型制药企业。目前,苏州二叶制药有限公司以一致性评价补充申请过评一致性的共有10个品种,1个为首家过评,还有3个按新注册分类化学仿制药申报上市的品种。11月共有2个品种6个一致性评价补充申请受理号被受理,分别为注射用头孢他啶和注射用头孢唑肟钠。
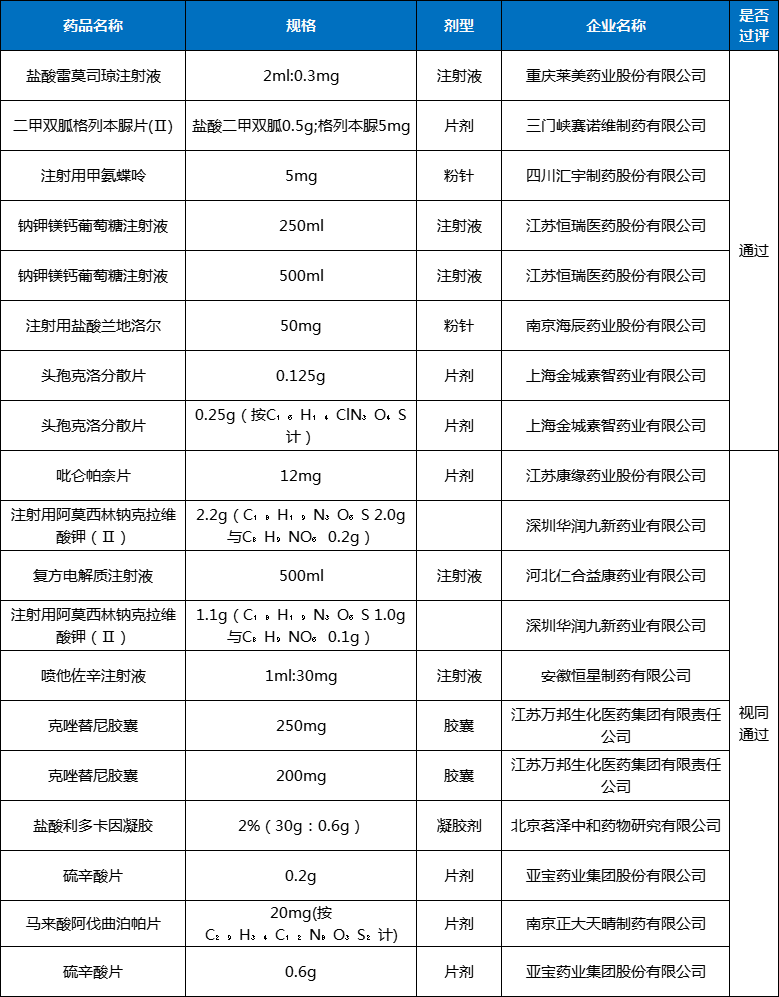
附表1:2023年11月首家通过一致性评价详情表
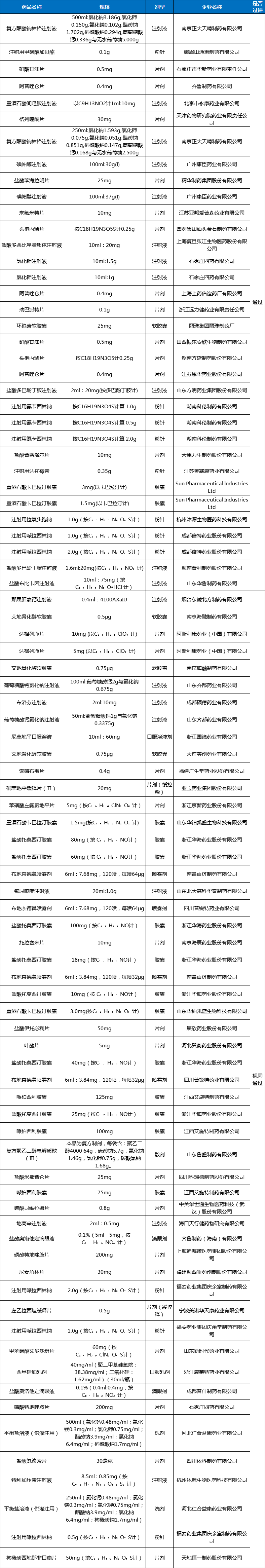
附表2:2023年11月通过(含视同通过)一致性评价(过评厂家数为2-10)详情表
附表3:2023年11月申报一致性评价详情表

如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030