https://www.cphi.cn 2024-04-03 10:29 来源:药渡Daily 作者:江篱
2024年3月25日,AstraZeneca旗下专注于罕见疾病的子公司Alexion Pharmaceuticals宣布,公司C5抑制剂Ultomiris(Ravulizumab-cwvz)在美国获批用于治疗成人抗水通道蛋白4(AQP4)抗体阳性(Ab+)视神经脊髓炎谱系障碍(NMOSD)。2021年,阿斯利康斥资390亿美元收购Alexion Pharmaceuticals,Alexion的业务范围主要集中于针对超级严重罕见病的孤儿药研发与市场推广。

视神经脊髓炎谱系疾病(NMOSD)是一种罕见的、终生的、进展性致衰弱的中枢神经系统自身免疫性疾病,以视神经和脊髓的炎性病变为特征。患者会经历不可预测的、复发和恶化的病程,并可能导致永 久性残疾。美国NMOSD成人诊断患病率估计约为6,000人。
本次获批是基于CHAMPION-NMOSD临床III期试验研究结果,该研究是一项全球III期、开放标签、多中心试验,评估Ultomiris在成人NMOSD中的安全性和有效性。主要研究终点为出现首次疾病复发的时间、治疗组相比对照组复发风险的降低。次要研究终点包括年复发率,Hauser步行指数(HAI)、欧洲五维度健康量表(EQ-5d)、EDSS分值相比基线的改变。
主要临床终点:经独立评审委员会确认,Ultomiris达到了首次试验中复发时间的主要终点。在中位治疗持续时间为73周的Ultomiris患者中观察到零复发[复发风险降低:98.6%,风险比(95%CI):0.014(0.000,0.103),p<0.0001]。
![主要临床终点:经独立评审委员会确认,Ultomiris达到了首次试验中复发时间的主要终点。在中位治疗持续时间为73周的Ultomiris患者中观察到零复发[复发风险降低:98.6%,风险比(95%CI):0.014(0.000,0.103),p<0.0001]。](https://cimg.cphi.cn/img_Cphi_cn/news/2024_04/Mimg_2404031039812411.png)
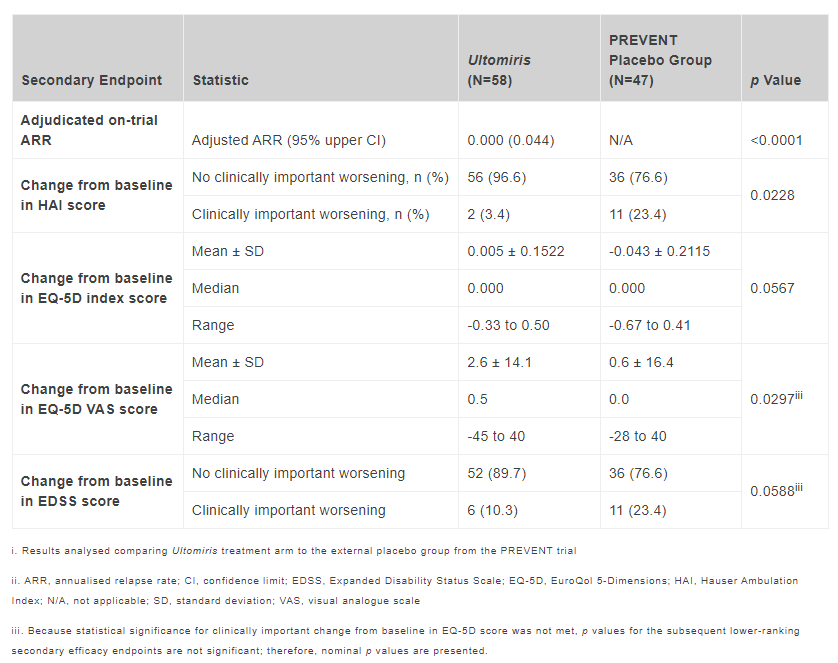
次要临床终点:以HAI评分代表的疾病恶化患者比率,试验组为3.4%(2/58),对照组为23.4%(11/47),风险比值比0.155(p=0.0228)。相比基线,试验组HAI变化为-0.1,对照组为-0.5。依EDSS评估显示的疾病恶化患者比率,试验组89.7%,对照组为33.2%
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030