https://www.cphi.cn 2023-05-11 14:48 来源:CPHI制药在线
5月10日,再鼎医药递交的「瑞普替尼 (Repotrectinib)」上市申请被CDE拟纳入优先审评,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。

Repotrectinib是靶向作用于非小细胞肺癌和晚期实体瘤ROS1和NTRK致癌因子的新一代激酶抑制剂,其设计比现有的靶向药物体积更小更灵活,因此可以绕过ROS1、NTRK和ALK突变的肿瘤中发现的某些耐药机制。在经治和未经治激酶抑制剂的患者中,Repotrectinib显示出抗肿瘤活性和持久应答。
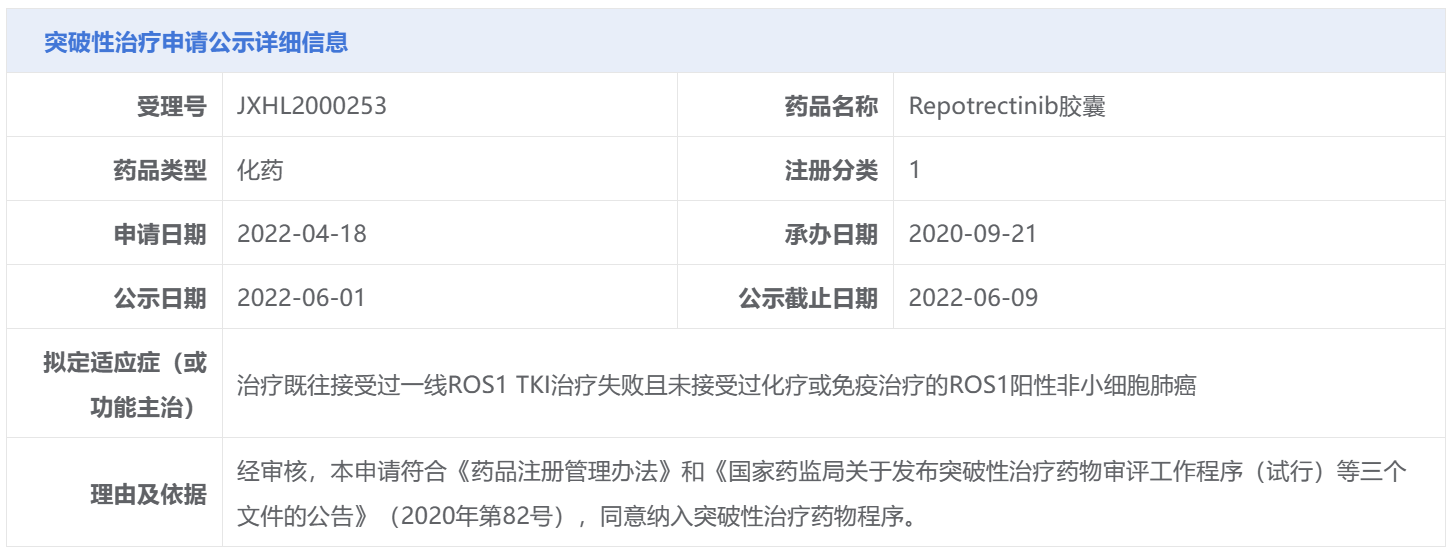
此前,Repotrectinib曾被CDE授予三项突破性治疗认定,分别用于治疗:ROS1 TKI初治的ROS1阳性非小细胞肺癌患者;既往接受过一线ROS1 TKI治疗失败且未接受过化疗或免疫治疗的ROS1阳性非小细胞肺癌;既往接受过一线ROS1 TKI以及一线含铂化疗治疗失败的ROS1阳性非小细胞肺癌。


在美国,Repotrectinib曾被FDA授予三项突破性疗法认定,用于治疗未接受过ROS1 TKI治疗的ROS1阳性转移性非小细胞肺癌,以及既往接受过一个或两个前线TRK TKI治疗、无论是否接受过化疗,且没有令人满意的替代疗法的NTRK基因融合的晚期实体瘤患者。
而且,Repotrectinib还被FDA授予的四项快速通道资格认定,分别用于:ROS1 TKI初治的ROS1阳性晚期非小细胞肺癌患者;既往曾接受过一线铂类化疗和一线ROS1 TKI治疗的ROS1阳性晚期非小细胞肺癌患者;既往接受过一线ROS1 TKI、未接受过铂类化疗的ROS1阳性晚期非小细胞肺癌患者;既往至少接受过一线化疗以及一或两线TRK TKI治疗后进展且没有满意替代治疗的NTRK阳性晚期实体瘤患者。
Repotrectinib由Turning Point Therapeutics研发。2020年7月,再鼎医药与Turning Point Therapeutics达成一项独家授权协议,获得Repotrectinib在大中华区(中国大陆、中国香港、中国澳门和中国台湾)的开发及商业化授权。
针对ROS1阳性非小细胞肺癌,已开展的1/2期临床试验TRIDENT-1研究结果显示:在TKI初治和TKI经治的ROS1融合阳性晚期NSCLC患者中,Repotrectinib均显示出持久活性。在较长的随访时间内,Repotrectinib耐受性良好,安全性可管理。而且,不同年龄和性别亚组的疗效和安全性基本一致。
具体疗效数据为:(1)在71名未接受ROS1 TKI靶向治疗的患者中,经盲态独立中心影像(BICR)评估客观缓解率(cORR)为78.9% (95% CI, 67.6–87.7) ,其中4例患者(6%)达到完全缓解(CR),52例患者(73%)达到部分缓解(PR);(2)对于ROS1 TKI经治患者:在56例接受过1个前线ROS1 TKI并且未接受化疗或免疫治疗的患者中,经BICR评估的cORR为37.5%(95% CI, 24.9-51.5);在26例接受过1个前线ROS1 TKI + 1个前线含铂化疗的患者中,经BICR评估的cORR为42.3%(95% CI, 23.4-63.1);在18例接受过2个前线ROS1 TKI并且未接受化疗或免疫治疗的患者中,经BICR评估的cORR为27.8%(95% CI, 9.7-53.5)。
安全性方面,Repotrectinib耐受性良好,治疗期间出现的不良事件(TEAE)主要为1-2 级,无4-5级TEAEs发生。头晕是最常见的不良反应,发生率为61.3%,其中73.2%(199/272)的头晕为1级,无头晕导致的治疗终止。
此次,Repotrectinib治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者的上市申请被CDE拟纳入优先审评,将加速Repotrectinib在国内的上市进程。
关于ROS1阳性非小细胞肺癌及其治疗进展
ROS1是一种编码受体酪氨酸激酶的基因,与间变性淋巴瘤激酶(ALK)结构相似。ROS1融合基因,最初发现于1987年,后于2007年在非小细胞肺癌(NSCLC)患者体内发现。
ROS1与EGFR、ALK等靶点一样都是非小细胞肺癌(NSCLC)明确的驱动基因,其异常活化可激活多条下游信号通路,包括RAS-RAF-MEK-ERK(MAPK)、PI3K-AKT-mTOR、JAK-STAT3和VAV3-RHO通路。ROS1激活后,在激酶结构域第2274和2334位酪氨酸残基发生磷酸化,并增强下游底物蛋白活性,从而促进肿瘤细胞的生存、生长、增殖、迁移和侵袭。
融合(重排)是ROS1基因的主要变异类型,目前至少有55种ROS1融合形式在成人和儿童的多种癌症类型中被发现。与NSCLC相比,ROS1融合在某些罕见癌症,如Spitzoid肿瘤和炎症性肌成纤维细胞肿瘤中的发生概率更高。在NSCLC患者中,ROS1基因融合占比仅为1%-2%,但由于肺癌发病率高,ROS1阳性NSCLC患者体量不可小觑。
目前,全球已批准两款治疗ROS1阳性NSCLC的药物,即克唑替尼和恩曲替尼。其中克唑替尼是一款针对ALK、c-MET和ROS1的小分子抑制剂,原研药Xalkori于2016年3月被FDA批准用于治疗ROS1阳性的转移性NSCLC,2017年11月在国内被批准用于治疗ROS1阳性的晚期NSCLC。
恩曲替尼是一款针对 ROS1、ALK、TrkA(由基因 NTRK1 编码)、TrkB(由基因 NTRK2 编码)和TrkC(由基因NTRK3编码)的小分子抑制剂,可通过血脑屏障,原研药Rozlytrek于2019年8月被FDA加速批准用于治疗ROS1阳性的转移性NSCLC成年患者,以及NTRK基因融合阳性、初始治疗后疾病进展或无标准治疗方案的局部晚期或转移性成人或儿童实体瘤患者。2022年8月,Rozlytrek在国内被批准用于治疗ROS1阳性的局部晚期或转移性NSCLC成人患者。
此外,目前全球还有多款新药被开发用于治疗ROS1阳性NSCLC,如葆元医药/信达生物的他雷替尼(Taletrectinib)、正大天晴的TQ-B3101、辉瑞/基石药业的洛拉替尼(lorlatinib)
他雷替尼是新一代、同类最 佳的强效ROS1抑制剂,2022年3月被CDE纳入突破性治疗品种,用于既往未经ROS1 TKI治疗和既往接受ROS1 TKI治疗失败的 ROS1 融合阳性NSCLC患者。已公布的在中国患者中开展的2期研究TRUST试验的初步结果显示:针对未接受过靶向治疗的ROS1阳性NSCLC患者,他雷替尼的整体缓解率高达92.5%;针对先前接受过克唑替尼治疗的ROS1阳性NSCLC患者,他雷替尼的整体缓解率也达到了50.0%,且78.9%的患者疾病稳定、未发生进展。
TQ-B3101是一款靶向ALK、ROS1和MET的新型小分子受体酪氨酸激酶抑制剂,临床前研究表明其具有良好的抑瘤活性和作用时间。2022年6月,TQ-B3101在国内申报上市,用于治疗ROS1阳性NSCLC。2022欧洲肺癌大会(ELCC)上公布的TQ-B3101单药治疗ROS1阳性NSCLC的2期临床研究的数据为:截至2021年10月15日,111例患者接受了TQ-B3101治疗,中位随访12.1个月。1例患者达到完全缓解,86例患者达到部分缓解,ORR为78.4%,DCR为87.4%。中位PFS为15.6个月,中位DoR为 20.3个月,中位OS尚未达到,12个月和24个月OS率分别为98.1%和88.1%。
洛拉替尼是一种具中枢神经系统穿透力的第三代ALK/ROS1酪氨酸激酶抑制剂(TKI),目前已被批准用于治疗ALK阳性的局部晚期或转移性NSCLC患者。2021年6月,基石药业与辉瑞达成合作,共同在大中华地区共同开发洛拉替尼治疗ROS1阳性晚期NSCLC。2022年1月,洛拉替尼治疗ROS1阳性晚期NSCLC的临床试验申请(IND)获NMPA批准。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030