https://www.cphi.cn 2021-12-24 09:11 来源:新浪医药新闻 作者:药疯
近年来,在国家大力推进大众创业万众创新的政策下,国内新药研发迎来了空前的发展。创新大环境下,国内新药IND申请的关注度已大不如前,随之,NDA申请越来越受到各方的青睐。2021全年,无论是1类创新药,还是2类改良新药,都有哪些国产品种首次进入到NDA受理状态?这些品种具有怎样的特点和潜力?对研究者有何指导意义?请看本稿件。
2021全年首次进入NDA阶段的1类新药
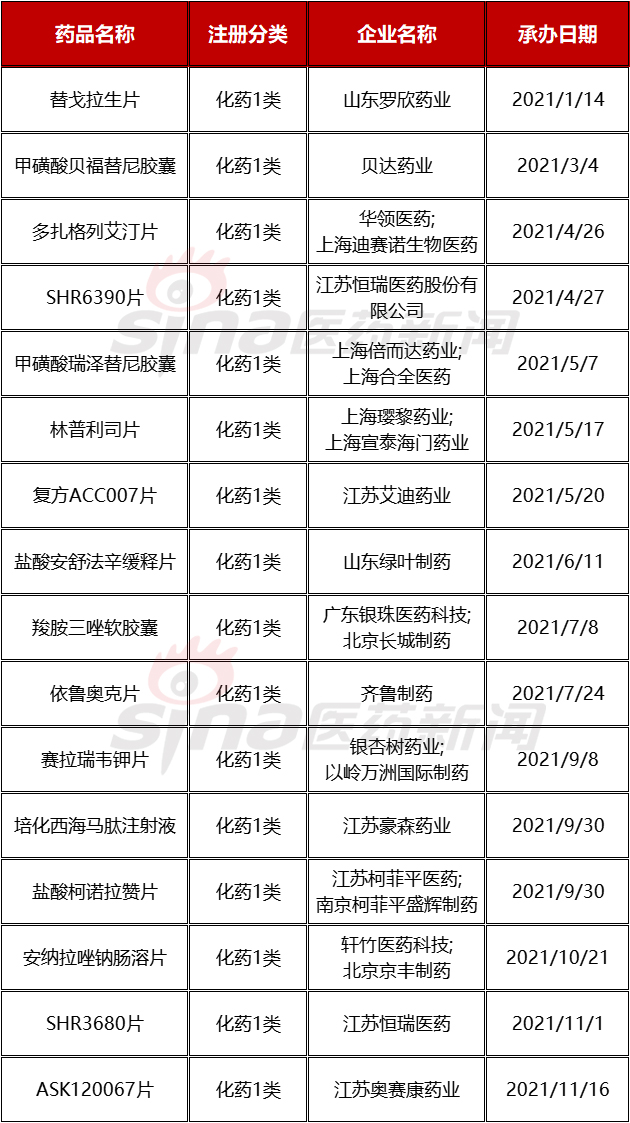
通过数据检索,截止发稿,2021年全年首次进入到NDA阶段并获得受理承办的化学1类品种共有16个。
相关品种的适应症以肿瘤为主,占比50%,具体有江苏恒瑞的2个品种SHR6390片(CDK4/6-乳腺癌)和SHR3680片(AR-前列腺癌)、贝达药业的甲磺酸贝福替尼(EGFR-T790M-非小细胞肺癌)、上海倍而达的甲磺酸瑞泽替尼(EGFR-T790M-非小细胞肺癌)、上海璎黎药业的林普利司片(PI3Kδ-淋巴瘤)、广东银珠医药科技的羧胺三唑(非小细胞肺癌)、齐鲁制药的依鲁奥克(ALK/ROS1-非小细胞肺癌)、江苏奥赛康药业的ASK120067片(EGFR-T790M-非小细胞肺癌);且由上不难看出,EGFR-T790M突变,即EGFR的3代药物,有3款品种进入NDA,再结合当前已上市并以奥希替尼为代表的3代药物品种,其市场无疑将进入到白热化状态。
其他NDA阶段品种,还涉及胃肠道、糖尿病、免疫、肝炎、贫血等,详见下表。
表1.1 2021全年首次进入NDA阶段的1类新药
2021全年首次进入NDA阶段的2类新药
自最新版化学药品注册分类实施至今,2类改良新药的行业关注度骤升,很多企业都希望在2类新药方向能够取得一定成就,以形成技术壁垒。基于此,无论是注册申报还是进展状态,数量都在每年递增。
按照分类,2类新药还可以进一步分为2.1、2.2、2.3、2.4,其要求如下表;而近年来对于2类新药的注册申报,主要集中在2.2类和2.4类品种,且2.1类目前是注册申报2类中最少的类别。
表2.1 化学药品新注册分类、说明及包含的情形

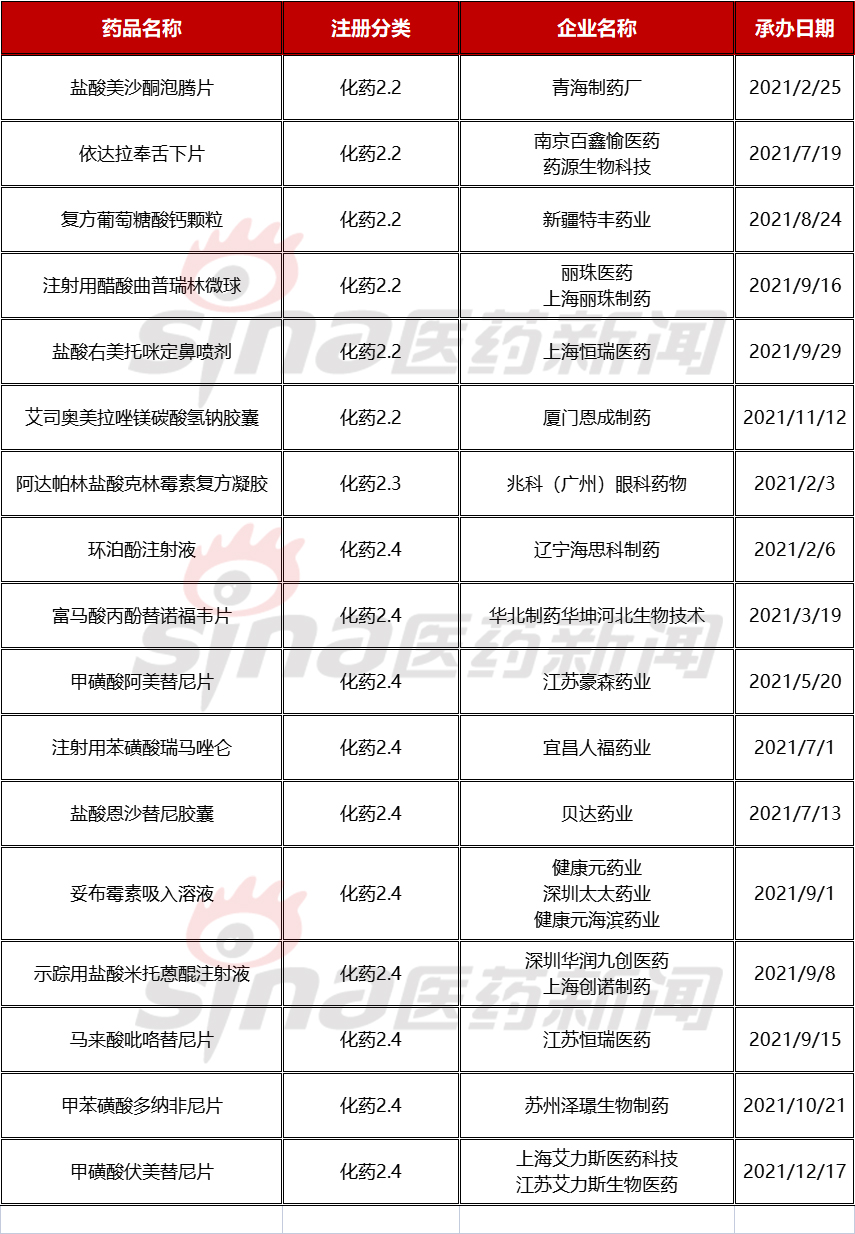
通过查询2021年进入NDA阶段的2类新药,并进一步剔除非首次进入品种,共有17个品种首次进入以2类新药NDA的状态获得CDE的承办,详见表2.2。
进一步对品种进行研究发现,主要有以下特征:
国产1类新药上市后,新适应症的后续申报,即2.4类;
传统2类申报方向,已上市药物的新制剂,即2.2类。
对于国产1类新药上市后,继续以2类进行NDA申报,已是当前国产创新药的常规操作方式;如辽宁海思科制药的环泊酚注射液、江苏豪森药业的甲磺酸阿美替尼片、贝达药业的盐酸恩沙替尼胶囊、上海艾力斯医药的甲磺酸伏美替尼片等。
对于2.2类的创新制剂,按照现今审评要求,需要具有明显临床优势,在一定程度上反应了制剂学对药品的优化改良效果,体现着一个企业对制剂技术的创新能力,如丽珠医药的注射用醋酸曲普瑞林微球、上海恒瑞医药的盐酸右美托咪定鼻喷剂、药源生物科技的依达拉奉舌下片等。
表2.2 2021全年首次进入NDA阶段的2类新药
NDA品种特点及借鉴意义
对于2021年首次进入NDA阶段的1类创新药,品种方面主要具有以下特点:
大部分仍为me-too类型,创新力不显著,但开发速度已具高水平;
适应症领域以肿瘤为主,进一步区分是以非小细胞肺癌为主,罕见肿瘤亟待探索;
开发NDA品种的企业越来越多,程序化的壁垒正在打破,创新性的实质更加难以获得等。
而对于2021年首次进入NDA阶段的2类改良新药,品种方面主要具有以下特点:
传统2.2/2.4开发模式为主,尚未获得惊艳的改良;
国内制剂技术的创新能力,急需强化;
一些1类新药其本质是2.1类改良,但因各种原因,企业不会主动“降维”等。
综上,2021年的国内1类新药+2类改良的首次NDA申请,已明显形成“增速和增数”。对于国人尤其是病患,选择更多,利好自不必说;对于国家审评部门,NDA工作量自然是加重加大的;对于部分企业来说,终于交上了最终的答卷,等待着官方的结论和市场的正式检验。
而未来,随着行业的竞争激烈,在国内me-too向FIC转换的进程中必将带来药品创新能力的持续提升,同时势必满足更多尚未满足的临床需求。
参考:
1.CDE官网数据
2.NMPA官网数据
3.各大药企官网披露信息
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030