https://www.cphi.cn 2018-01-03 10:30 来源:转载
8、甲磺酸仑伐替尼胶囊
卫材
仑伐替尼是一种多靶点激酶抑制剂,可以阻滞肿瘤细胞内包括VEGFR1-3、FGFR1-4、PDGFRα、KIT、RET在内的一系列调节因子。2015/2/13以优先审评和孤儿药身份获得FDA批准上市,用于治疗**碘难治的高风险分化型甲状腺癌。2016/5/13被FDA批准联合Afinitor治疗既往接受过anti-VEGF疗法的晚期肾细胞癌。

中国是肝癌患者大国,每年有大约39.5万例新确诊肝癌患者和38万例肝癌死亡患者。索拉非尼是首个有明确证据显示能够改善晚期肝癌患者生存期的系统治疗药物,也是国内肝细胞癌患者的临床一线标准用药。不过在与索拉非尼的头对头REFLECT研究(Study 304)中,仑伐替尼凭借生存期优势(13.6 vs 12.3个月)胜出。
在肝癌适应症上,卫材2017年6月在日本提交了上市申请,2017年7月向EMA和FDA提交了上市申请,2017/11/3向CFDA提交上市申请,2017/12/18获得CDE的优先审评。FDA授予过仑伐替尼治疗肝细胞癌的孤儿药资格,在9月27日受理了卫材的sNDA,是按照10个月标准审评流程做出审批决定,将在7月底前做出审批决定。仑伐替尼在国内预计会在2018Q4获得CFDA批准。
9、罗沙司他胶囊
珐博进/阿斯利康
罗沙司他(roxadustat,FG-4592)是一种低氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂,可抑制HIF的泛素化降解,帮助机体产生更多的红血球,开发用于治疗CKD患者的贫血,是FibroGen优先为中国患者打造的一款first in class新药。
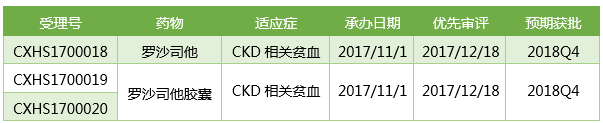
贫血是CKD患者很常见的一种疾病,无论是透析还是非透析CKD患者,发病率和死亡率都非常高。CKD可发病于任何年龄,老年人中更为常见,中国大约有1.195亿CKD患者。中国接受透析的CKD人群超过40万,而且以两位数的增幅快速增长,因此需要抗贫血疗法的患者日益增多。
CKD患者当前的抗贫血疗法主要是注射促红细胞生成素,Roxadustat是一种低氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂,可以提供一种更便捷(口服)、更安全的治疗选择。
罗沙司他用于治疗透析依赖性慢性肾病患者(DD-CKD)以及非透析依赖性慢性肾病患者(NDD-CKD)贫血的上市申请于2017/11/1获得CDE承办受理,在2017/12/18被CDE以"与现有治疗手段相比具有明显治疗优势"的理由纳入优先审评,预计会在2018Q4获得CFDA批准,有望成为首个率先在中国上市的first in class药物。罗沙司他在中国上市后的商业推广工作由阿斯利康负责。
10、聚乙二醇洛塞那肽注射液
豪森药业
聚乙二醇洛塞那肽是豪森自主研发的长效GLP-1受体激动剂,用于治疗2型糖尿病,只需每周注射1次,获得国家重大新药创制专项资助。
GLP-1是人体胃肠道黏膜天然分泌的一种“肠促胰素”,可以与胰岛细胞上的受体结合并刺激胰岛素分泌,进而产生降低血糖的作用。GLP-1受体激动剂类降糖药物的优点在于低血糖事件的发生率明显低于胰岛素,而且可以减少食物摄取和延缓胃排空,有利于控制体重,可以保护胰岛β细胞功能,也是当前市场规模增长最快的一类降糖药。

注:仅指截至文章发布日尚未被纳入优先审评
目前国内获批上市的GLP-1受体激动剂类降糖药均为短效制剂,分别是艾塞那肽(每日2次)、利拉鲁肽(每日1次)、贝那鲁肽(每日3次),利司那肽(每日1次)。其中,利拉鲁肽通过谈判形式已经进入了2017国家医保目录,价格为410元(3ml:18mg/支,预填充注射笔),限二甲双胍等口服降糖药或胰岛素控制效果不佳的BMI≥25的患者,并需二级及以上医疗机构专科医师处方。
阿斯利康在中国提交了长效形式GLP-1制剂注射用艾塞那肽微球的上市申请,目前处于在审批状态,上市在即。豪森药业提交的聚乙二醇洛塞那肽注射液的上市申请在2017/12/6获得CDE承办受理,目前尚未被纳入优先审评,快的话可在2018Q4获得批准上市,成为第一个上市的国产长效GLP-1制剂。
11、塞瑞替尼胶囊
诺华
塞瑞替尼是第二代间变性淋巴瘤激酶(ALK)抑制剂,2014/4/29被FDA批准用于克唑替尼治疗不耐受或疾病进展的ALK+非小细胞肺癌,2017/5/26被FDA批准一线治疗ALK+转移性非小细胞肺癌。
ASCEND-4研究结果显示,与标准一线化学疗法(培美曲塞、铂类)相比,Zykadia可使ALK+NSCLC患者的PFS明显延长(16.6 vs 8.1个月)。对于无脑转移的患者,Zykadia和化疗组的中位PFS分别为26.3和8.3个月;对于伴有脑转移的患者,Zykadia和化疗组的中位PFS分别为10.7和6.7个月。对于可检测到脑转移的ALK+NSCLC患者,Zykadia治疗组的总体颅内应答率为57%(n=28),化疗组为22%(n=27)。

注:仅指截至文章发布日尚未被纳入优先审评
诺华提交的塞瑞替尼胶囊上市申请在2017/12/11正式获得CDE承办受理,后面被纳入优先审评应该没有悬念(临床申请获得过优先审评),预计可在2018Q4获得CFDA批准。
12、依洛尤单抗注射液
安进
PCSK9单抗是他汀类药物之后最被看好的一类降脂药,除了强效的降LDL作用外,心血管获益已经被写进药品标签。12月1日宣布,FDA批准安进Repatha(evolocumab,依洛尤单抗)的补充生物制品许可申请,可用于降低伴有心血管疾病的成人患者的心脏病发作(心肌梗死)、卒中和行冠状动脉重建术的风险。依洛尤单抗是第一个取得该适应症的PSCK9单抗。 在代号为FOURIER的涉及27564例患者的大型心血管结局研究中,依洛尤单抗联合剂量他汀类药物可使关键次要复合终点(主要心血管事件,包括首次心脏病发作、卒中、心血管死亡)的风险降低20%,使主要复合终点(因不稳定心绞痛、冠状动脉重建术、心脏病发作、卒中而住院以及心血管死亡)的风险降低了15%。
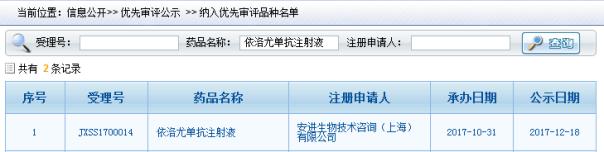
依洛尤单抗在中国的上市申请于2017/10/31获得CDE承办受理,2017/12/18被CDE纳入优先审评,顺利的话预计会在2018Q4获得CFDA批准。
除了上述12个重磅新药外,2018年还有其他一些新药比较值得关注,比如:
丹诺瑞韦钠片,歌礼生物的口服丙肝新药,上市申请已经被纳入优先审评,已经完成生产现场检查,预计2018Q1批准。
来迪派韦索磷布韦片,吉利德的第2款丙肝神药Harvoni,已经报产,2018年底前获批是大概率事件。
度拉糖肽注射液,礼来的长效GLP-1受体激动剂,礼来以含中国数据的国际多中心试验结果申请免临床,预计2018Q1会报产,2018年底之前获批并非没有可能。
磷丙替诺福韦片,史上的乙肝新药Vemlidy,Gilead以完成临床试验申请免临床,预计2018Q1会报产,2018年底之前获批并非没有可能。
此外,最近国产PD-1战场很不平静,BMS、信达率先报产之后,默沙东、恒瑞、君实、百济神州的上市申请将在2018Q1陆续抵达CDE,国内PD-1市场大战一片焦灼。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030